Nutrición
Todo sobre la vitamina B12. Bioquímica, diagnóstico, clínica y suplementación.

La vitamina B12 y su déficit son uno de los aspectos más complejos en cuanto al manejo clínico y diagnóstico. En este tema te ofrecemos un estudio integral de la B12 para que puedas integrarlo en tu práctica clínica.
1. VITAMINA B12, INTRODUCCIÓN Y FUENTES DIETÉTICAS
2. BIOQUÍMICA DE LA VITAMINA B12
3. METABOLISMO DE LA VITAMINA B12
4. DEFICIENCIA DE VITAMINA B12
5. SINTOMATOLOGÍA Y DIAGNÓSTICO DEL DÉFICIT DE VITAMINA B12
6. VITAMINA B12, EMBARAZO Y LACTANCIA
7. SUPLEMENTACION DE VITAMINA B12
8. BIBLIOGRAFÍA
1. VITAMINA B12, INTRODUCCIÓN Y FUENTES DIETÉTICAS
1.1 VITAMINA B12, HISTORIA, DESCUBRIMIENTO Y PRODUCCIÓN
La vitamina B12 es una vitamina hidrosoluble que pertenece a la familia de las vitaminas del grupo B, esencial para una correcta eritropoyesis, síntesis de ADN y mantenimiento del sistema nervioso, entre otras funciones. En la literatura científica aparece también como cobalamina. La vitamina B12 es una cobalamina, formada por 4 anillos pirrólicos (estructura tetrapirrólica) que forman un núcleo corrina en torno a un átomo central de cobalto. Se dice que tiene una estructura corrinoide y, como se verá más adelante, otras estructuras corrinoides presentes en la naturaleza (como por ejemplo las que sirven como factores de crecimiento bacteriano) pueden contabilizarse en una analítica de B12 sérica, sin que éstas sean formas activas, con las limitaciones que ello puede conllevar.
Esta vitamina fue todo un misterio durante el siglo XIX. El doctor Addison observó a mediados de ese siglo un cuadro clínico que bautizó como Anemia de Addison, y que otros médicos posteriormente empezaron a asociar con problemas gástricos. En 1872 Bierner lo bautizó como anemia perniciosa. Los primeros experimentos en animales llevados por Whipple, en la década de los años 20 del siglo XX, sobre enzimas hepáticas, enfermedad hepática y hemoglobina, demostraron que la ingesta de hígado y de sus extractos mejoraba los cuadros de anemia convencional, lo que sirvió para abrir una vía de investigación para la anemia perniciosa, todavía un gran misterio. Minot se interesó mucho por los estudios de Whipple, y la posible aplicación de una dietoterapia con grandes cantidades de hígado a diario, siendo esto un éxito.
William B. Castle hace un importante descubrimiento: el factor intrínseco, y habla de la existencia de un factor extrínseco que debía unirse a éste; posteriormente se supo que ese factor extrínseco era realmente la vitamina B12. Se observó que los pacientes con anemia perniciosa instaurada mejoraban con la ingesta de hígado, y posteriormente se empezaron a administrar extractos concentrados a partir de hígados animales, y que sirvieron durante años como la alternativa más viable para el tratamiento de la enfermedad, hasta que se descubrió que era la vitamina B12 la que revertía los síntomas y se trabajó en su síntesis aislada que tuvo lugar hacia mitad- tres cuartos del siglo XX.
De ahí que en base a estos hechos y a su presencia hepática en no pocas ocasiones se asocie a un origen animal. Y no es incorrecto. La vitamina B12 se encuentra en los alimentos de origen animal (excepto la miel), en cantidades variables según procedencia (animal, y parte del animal; siendo el hígado el lugar más destacado de acumulación, como ya hemos visto).
En realidad, si profundizamos un poco más, tiene origen primario bacteriano (gracias a ello a día de hoy se produce en laboratorio). Los animales deben realizar un aporte adecuado de ella para asegurar su presencia, bien sea a través de la ingesta considerada normal fisiológicamente hablando, es decir, comiendo a otros animales y sus vísceras (aplicado a animales carnívoros), o bien según el tipo de animales comiendo directamente de un entorno/suelo rico en bacterias precursoras. Hay algunas excepciones: los rumiantes pueden producirla en su segundo estómago mediante la microbiota allí presente (con necesidad de un precursor dietético micronutricional, el cobalto), o el pescado a partir de su microbiota productora, mediante la ingesta de fitoplancton, o comiendo otros pescados.
En los animales alejados totalmente de entornos naturales y utilizados por la industria ganadera, se realiza el aporte mediante suplementación: piensos enriquecidos o inyecciones (método más habitual debido a las circunstancias de estabulado-producción y privación de alimentación natural; pero también utilizado en animales con más libertad como profilaxis). El nombre de cobalamina proviene del grupo corrina-cobalto que lo integra, y son los cristales del propio cobalto los que le otorgan su color rojo particular. La biosíntesis microbiana de la vitamina B12 ocurre a través de rutas aeróbicas o anaeróbicas. Se da en bacterias y arqueobacterias. La producción industrial se hace a partir de fermentación microbiana. Algunas de las bacterias más habituales que producen B12:
La primera cepa bacteriana utilizada para su síntesis fue el Lactobacillus Lactis Doner, aunque actualmente se sabe que pueden sintetizarla muchas otras bacterias, como Pseudomonas denitrificans y Propionibacterium shermanii, que suelen ser utilizadas en la síntesis de laboratorio para suplementación.
La población vegana solamente puede obtener esta vitamina a partir de suplementos o alimentos fortificados, y es esencial y de vital importancia su aporte en todas las etapas de la vida. Los posibles aportes marginales microbianos directos a partir de tierras, alimentos sucios, estiércol / materia fecal o aguas de ciertos ríos o contaminadas son un sinsentido, a pesar de que algunos círculos de personas han llegado a proponerlos como fuente "interesante" para saltarse la suplementación (hablaremos más delante de ello).
Algunos mamíferos herbívoros tienen producción propia bacteriana y son capaces de reabsorberla; ello ha creado opiniones de que los humanos también son capaces de hacerlo solo por el hecho de ser mamíferos, y aunque hay síntesis en algunas zonas no es reabsorbible al encontrarse lejos del íleon. Además, se ha visto que en muchos casos en esos animales concretos y bajo ciertas condiciones puede no ser suficiente su producción endógena y son a menudo suplementados por protocolo para evitar problemas y optimizar los niveles.
Existe también la creencia popular de que las algas, setas y fermentados contienen B12 en abundancia, pero se trata de análogos inactivos que pueden falsear una analítica y entorpecer el metabolismo de la B12 activa. (Nota: en algunos casos muy específicos y en condiciones determinadas en algunas algas y setas podría haber ciertas fracciones activas, pero son cantidades muy pequeñas que no se han demostrado en ningún momento útiles ni viables como estrategias, y puede seguir habiendo análogos).
Por otro lado, los sujetos ovolactovegetarianos no suelen llegar en muchos casos a las recomendaciones de consumo estipuladas y sigue siendo de aplicación el principio de precaución de suplementar; ya que las cantidades diarias teóricas a consumir de ciertos alimentos no suele ser habitual que se cumplan (e incluso a veces cumpliéndolas puede no haber un buen estatus final por diferentes motivos).
Y no solamente es la cantidad total lo que importa; también son muy determinantes el timing y el reparto, existiendo una crononutrición específica (no es lo mismo comer 6 huevos de golpe, que tomarlos en dos o tres comidas separadas algunas horas entre ellas: aunque la cantidad de B12 teórica sea la misma la absorción será distinta). Además, tendríamos de por medio temas digestivos, genéticos y propios de cada persona (no todos absorbemos, retenemos y almacenamos igual). Podemos aplicar heurísticas de aproximación y métricas sencillas, a nivel promedio general, pero la respuesta final la va a regir la fisiología de cada persona.
La vitamina B12 es una vitamina altamente compleja y muy estudiada; a día de hoy se realizan constantes estudios sobre ella.
1.2. FUNCIONES DE LA VITAMINA B12
1.3 FORMAS FISIOLÓGICAS Y NO FISIOLÓGICAS DE LA VITAMINA B12
Podemos dividir a las diferentes formas en las que podemos encontrar la vitamina B12 en dos grupos:
Formas fisiológicas, que funcionan como coenzimas para reacciones metabólicas:
Otras formas: aquocobalamina, nitritocobalamina.
Todas las formas son compuestos químicos de forma molecular similar relacionados a nivel químico, que tienen función de vitamina. Son distintas formas en las que se puede representar a la vitamina.
1.4. FUENTES DIETÉTICAS DE LA VITAMINA B12
Solamente los productos de origen animal son fuente fiable de B12. En productos vegetales solamente aquellos que se encuentran fortificados (es decir, que han suplementado al producto). Por ejemplo, serían productos fortificados los -mal llamados- cereales “de desayuno” o algunas bebidas vegetales y yogures de soja que vengan con B12 adicionada.
En población vegetariana muchas veces se les anima a consumir productos fortiticados para obtener B12. Hay que tener en cuenta que generalmente son productos procesados y suelen tener altos contenidos en azúcar, y contemplar eso si se va a utilizar esa vía como obtención, pues no parece muy coherente obtener B12 a partir de productos procesados.
Además, suele ser engorroso e incómodo tener que contar/calcular cuantos microgramos entran en cada ración que tomemos, hacer varias ingestas al día para optimizar absorción y que se libere la saturación del FI, etc.
1.5. EL PROBLEMA DE LOS ANÁLOGOS DE LA VITAMINA B12
Los análogos de B12 son estructuras corrinoides que contienen cobalto pero no tienen la actividad de la vitamina, ya que tienen alteraciones en el núcleo corrínico. Tienen poca afinidad por el factor intrínseco.
Problemas de los análogos:
El alga espirulina no ha demostrado poder resolver problemas relacionados con la B12. Mucha gente la está tomando pensando que contiene B12 real, cuando realmente va cargada de análogos. Ralph Carmel, uno de los principales investigadores de la vitamina B12, publica un estudio en 1988 con varios sujetos analizados donde se sugiere la relación de que a más cantidad de análogos acumulados mayor riesgo de sintomatología neurológica y que ello podría explicar porqué algunos pacientes no experimentaban síntomas neurológicos (al menos hasta el momento) pero sí anemias.
Hay análogos naturalmente presentes y circulantes, en más o menos cantidad según sujetos, de manera totalmente normal. Hay personas “de serie” con más análogos y otras con menos. Otros alimentos habituales (tanto animales como vegetales) también aportan cantidades pequeñas de análogos que no implican problema.
2. BIOQUÍMICA DE LA VITAMINA B12
2.1. FUNCIONES, REACCIONES METABÓLICAS, CÓMO AFECTA UN DÉFICIT Y LA TRAMPA DE FOLATOS
La vitamina B12 tiene multitud de funciones. También actúa, al igual que muchas vitaminas del complejo del grupo B, como una coenzima. A continuación, se listan las más importantes y se especifica lo que sucede en caso de déficit:
Participa en dos reacciones metabólicas muy importantes:
A continuación, vamos a resumir y comentar el circuito completo:
MTHFR (Metil Tetra Hidro Folato Reductasa): es una enzima del metabolismo de los folatos. Cataliza la conversión de metilentetrahidrofolato (o 5,10-M-THF) a metiltetrahidrofolato (M-THF). El M-THF, recordemos, es un cofactor para degradar la homocisteína y que su paso a metionina sea el correcto. Cuando ingerimos alimentos con la dieta, obtenemos THF, que ha de pasar a M-THF para realizar sus correctas funciones y actuar como cofactor de todo lo que estamos viendo. Si la MTHFR falla o no es capaz de hacer sus funciones plenamente en ese paso, habrá un problema asociado a los folatos. Esto se asocia a temas genéticos. Si se sospecha de ello se puede solicitar analítica de las mutaciones (las habituales son C677T y A1298C).
3. METABOLISMO DE LA VITAMINA B12
3.1. METABOLISMO, TRANSPORTE Y ALMACENAMIENTO DE LA VITAMINA B12
La B12 dietética incluida en los alimentos se encuentra junto a proteínas de unión, de las cuales se liberará en el estómago por la pepsina y la acidez del ácido clorhídrico secretado.
Una vez la B12 se ha liberado de las proteínas dietéticas se une a la haptocorrina salivar, una proteína de unión (también llamada proteína R o cobalofilina) que se secreta en las glándulas salivares y se une en el estómago con la cobalamina, la cual tiene gran afinidad a esta proteína, formando un complejo junto a ella en su paso hacia el duodeno.
Una vez que llega al duodeno, se libera de las proteínas R por la acción de las proteasas y del bicarbonato pancreático, que provocan la eliminación del complejo formado inicialmente, quedando la B12 libre.
Esta vitamina B12, se unirá al factor intrínseco, también conocido como factor intrínseco de Castle en honor al científico William Castle, a quien hemos mencionado anteriormente, y que realizó importantes investigaciones y aportaciones al respecto. El factor intrínseco (FI) es una glicoproteína secretada por las células parietales de la mucosa gástrica que tiene la función de unirse a la vitamina B12 una vez ésta se ha desprendido de las proteínas R, otorgándole resistencia a las proteasas gástricas y pancreáticas, formando un complejo B12+factor intrínseco que se conoce como complejo de Castle. El factor intrínseco tiene una capacidad máxima de unión y se satura sobre los 1.5-2 μg de vitamina B12 ingerida (si tomamos más de esa cantidad, se absorbe menos; y menos cada vez a medida que aumenta la dosis).
En el íleon terminal el complejo de B12+Factor intrínseco se absorbe a través del reconocimiento de unos receptores específicos, que a su vez son los que limitarán la absorción en ingestas fisiológicas o dietéticas. Aquí se libera la cobalamina, y el factor intrínseco se degrada en los lisosomas (orgánulos celulares con enzimas hidrolíticas y proteolíticas).
Si nada de lo anterior ha fallado por el camino, la B12 ha llegado a su primer destino sana y salva; pero todavía le espera un trayecto importante mediante unos transportadores específicos (podemos ilustrarlos como "coches") hasta su destino final.
La B12 libre se une a unas proteínas R de transporte (los coches disponibles) presentes en plasma: las haptocorrinas, también llamadas cobalofilinas o transcobalaminas, de las cuales encontramos la transcobalamina I, II y III.
Hay debate sobre el tema de la I y la III, y si deberíamos hablar en general solamente de la transcobalamina I, o llamarla simplemente haptocorrina. Estas haptocorrinas transportan B12 pero no hacen entrega de la vitamina, tiene alta afinidad por análogos inactivos de B12, aunque se cree que por ello también pueden tener un papel en la eliminación de estos, y otras funciones que están aún en estudio y se desconoce bastante (entre ellas, el transporte de la B12 de almacenamiento).
La transcobalamina II es el "coche" principal y se conoce también a veces como simplemente transcobalamina (TC, o TC2 en según qué textos). Es el transportador más importante, ya que es la encargada del transporte activo de la vitamina y lleva una cantidad aproximada de un 20% (el 80% restante corresponde a la haptocorrina, pero será inactiva).

Muchas células pueden secretar TC, la cual se combina con la B12 libre en las células del íleon para formar holotranscobalamina (holoTC), que ingresa a la circulación portal y será la encargada de entregar la vitamina a las células, ya que transporta la fracción funcional que puede ser absorbida por los tejidos y se libera rápidamente en ellos por endocitosis (proceso de incorporación de moléculas a las células) a través de sus receptores específicos.
Es decir, la transcobalamina-2 (transportador) cargada con B12, es la holo-TC... La cobalamina finalmente se metaboliza en metilcobalamina y desoxiadenosilcobalamina. Entra en el plasma como metilcobalamina y se acumula como reserva en el hígado como desoxiadenosilcobalamina. El 50% (o más, según fuente literaria consultada y según sujeto) de la vitamina B12 se encuentra almacenada en el hígado, y aproximadamente encontramos 1 μg por cada gramo de tejido hepático. También se encuentran grandes cantidades en los riñones. A nivel muscular también hay B12. En la mayoría de tejidos no suele acumularse, sino que se recicla mediante un mecanismo de transporte activo.
Las reservas comprenden rangos de 1-6mg en adultos sanos (incluso pudiendo ser bastante más en el rango superior), siendo lo más habitual en promedio encontrar cantidades de 2-3 mg. Cuanto más grandes sean las reservas más grandes serán las pérdidas diarias normales, y viceversa: a menor pool (reservorio) de cobalaminas, menos B12 será eliminada, lo cual podría ser el resultado de una adaptación metabólica a cuando existen reservas bajas. Es decir, la fisiología de las reservas de B12 es: si tenemos muchas reservas, el organismo sabe que tiene de sobras y no se interesa mucho por salvaguardar y pierde más; y si tenemos pocas reservas, el organismo querrá tratar de ahorrar lo más que pueda (aunque sigue perdiendo igual, pero trata de resistir).
Se estima que cuando el pool corporal es de 300 μg o menos es cuando aparecerían signos de deficiencia. Pero no debe descartarse que puedan existir ya problemas por encima.
Una pequeña parte de la B12 almacenada se secreta continuamente en la bilis. De esa fracción, entre el 50% y el 80% vuelve a seguir los pasos ya comentados (desprenderse de proteínas R y unirse al FI) y es reabsorbido, mientras que el resto se pierde por las heces junto al resto de análogos corrinoides. Es lo que se denomina circulación enterohepática y es por este motivo que una deficiencia por ausencia dietética puede tardar años en darse si hay reservas suficientes aún en ausencia de aporte dietético, puesto que se parte generalmente de un pool alto y pérdidas diarias muy pequeñas si el mecanismo de reabsorción funciona en su punto máximo de eficiencia.
La cantidad de cobalaminas almacenada y cómo funcione el circuito enterohepático y la amortiguación de pérdidas generales a medida que disminuyen los niveles, es muy variable entre sujetos. No todo el mundo pierde igual ni al mismo ritmo. Y tampoco parten de los mismos niveles de reservas.
A más alto sea ese pool inicial, y a más eficiencia tenga la persona en el reciclaje y en la conservación de cobalaminas, más tardará en darse la deficiencia. Esto explica como hay casos que puedan manifestarse en unos meses , o bien en varios años. Y esto explica también cómo hay personas que dicen no haber tenido aún deficiencia en unos años, sin suplementarse y llevando dietas vegetarianas plenas. Ojo con esto.
Si hay aporte dietético o de suplementación y no hay problemas ni alteraciones en la ruta de transporte-absorción-excreción, las pérdidas son compensadas. Si hay ausencia de FI o secreción limitada, no se reabsorbe en el circuito enterohepático y se excreta, con lo cual el déficit llegará antes (pues está fallando el circuito enterohepático de reciclaje), de igual manera que si el aporte dietético no es adecuado llegará un momento donde la circulación enterohepática no será suficiente.
En las heces es donde se encuentra la mayor pérdida. Entre la B12 excretada encontramos la fracción secretada por la bilis que no ha pasado a circulación enterohepática, la que no se ha absorbido de los alimentos y la que ha sido sintetizada en el colon por microorganismos (que no puede ser absorbida ya que no se haya en el íleon ni va a pasar nunca por él). En las heces también se aprecia que una alta cantidad (hasta un 98%) de la B12 excretada son análogos de cobalamina, debido a que ha habido conversión de cobalamina en análogos por parte de microorganismos en el colon.
La otra vía de eliminación es la urinaria, la cual no suele ser destacable excepto cuando se excede la capacidad de unión sanguínea o se utilizan macrodosis a través de suplementación. Debido a la existencia de un reservorio utilizado de manera eficiente mediante el circuito enterohepático, un déficit por ausencia dietética de B12 puede tardar tiempo en presentarse si las reservas son correctas en el momento en el que cesa el aporte de la vitamina. Pero… ¿Cuánto tarda? Es algo indeterminado y dependerá de cada sujeto, reservas previas, gestión de las mismas y eficiencia del circuito enterohepático. Suele situarse en unos 3-4 años aproximadamente, habiendo sujetos donde tenga lugar mucho antes, o después.
3.2 ABSORCIÓN Y DIFERENCIAS ENTRE DOSIS FISIOLÓGICAS Y FARMACOLÓGICAS
El porcentaje de absorción va disminuyendo a medida que la dosis aumenta.
"Cuanta más dosis se toma, menos se absorbe"
En dosis bajas o moderadas, también llamadas fisiológicas, que son las que aportaríamos a través de la alimentación, (aunque podríamos meter aquí también la B12 aportada por alimentos fortificados, o suplementación en cantidades muy pequeñas), la absorción depende del factor intrínseco secretado y de los receptores intestinales del complejo de Castle, que son quienes regularán la absorción. Hay un mecanismo de absorción que en condiciones normales se satura aproximadamente sobre los 1.5-2 μg por comida. Si se excede esa cantidad en una sola toma, la absorción se vuelve dependiente de mecanismos pasivos y difusos, con muchísima menos eficiencia.
Regla sencilla: toda dosis en una sola toma mediante alimentos que exceda la capacidad de saturación del FI, se absorberá muy mal. Y si no producimos FI, imagínense. Se estima que en un período de entre 4-6 horas se recupera plenamente la capacidad de saturación, permitiendo una nueva dosis a igualdad de absorción y de capacidad de saturación que la anterior.
¿Cuánto absorbemos? Se resume que, en condiciones ideales y si la secreción de factor intrínseco es correcta, se absorbe aproximadamente una fracción del 50% por comida realizada. La EFSA en su último consenso recomienda por principio de precaución contemplar una absorción media estimada de un 40% por la cantidad de factores que pueden influir.
Por cada toma de 1 μg de B12 se absorbería aprox. ese 40-50%, pero recordemos que, si la toma es mayor, cada vez se absorbe menos, y que hay también un mecanismo de saturación y debe pasar un período de “recuperación” para que éste sea pleno nuevamente; por ello, hay autores que prefieren ser conservadores en cuanto no sobreestimar la absorción, y contemplar que no todos los alimentos tienen la misma tasa de absorción, ya que cuanto más rico sea en B12 menos se absorberá...
Ya fuera de las dosis bajas, al optar por protocolos con macrodosis de suplementación semanal o por dosis de remonte, debemos hacer un aporte muy alto de B12 para asegurarnos cubrir la absorción de una fracción pequeña pero suficiente, aún a expensas de que la inmensa mayoría de B12 del suplemento acabe no aprovechándose y sea eliminado debido a la menor eficiencia de absorción que encontramos por esta vía al no ser dependientes del factor intrínseco. El ejemplo puesto son las llamadas macrodosis o también conocidas como dosis farmacológicas, que solamente pueden ser aportadas a través de suplementos.
Este es el motivo por el cual, a principio de siglo XX, cuando se descubre que comer hígado mejoraba a los pacientes con anemia perniciosa, tenían que comer ingentes cantidades para lograr un "efecto farmacológico".
En estos casos, nos encontramos con una absorción aproximada de, con suerte, entre un 1-2% de la dosis aportada, pero no es raro que pueda llegar a ser incluso inferior (0,5%) según el tamaño de la dosis, reservas previas y otros factores y condiciones individuales de cada sujeto.
Ante estas dosis farmacológicas o macrodosis se acaba excretando en orina el excedente resultante, que no ha podido unirse ni al factor intrínseco ni unirse plenamente a la transcobalamina debido a que ha excedido la capacidad de unión en la proteína de transporte al encontrarse en dosis muy altas (dosis que habrá sido necesaria, no obstante, para asegurar una absorción determinada según objetivo y finalidad).
Las macrodosis de vitamina B12 se absorben incluso en ausencia de factor intrínseco y de ácido clorhídrico al no ser dependientes, por lo que son la estrategia válida de mantenimiento o remonte en procesos o estados donde no se está secretando esta proteína protectora, en gastrectomías, aclorhídrias, etc.

¿Cuánto duran las reservas? Desde meses a años. Dependerá de varios factores:
3.3. HOMOCISTEÍNA Y ÁCIDO METILMALÓNICO
Como hemos visto, en una anemia por carencia de B12 se encuentran elevadas tanto la homocisteína como el ácido metilmalónico, mientras que en una carencia de B9 (también causa de anemia megaloblástica) solamente es la homocisteína la que presenta niveles plasmáticos por encima de lo normal.
Homocisteína
La homocisteína es un homólogo del aminoácido cisteína que resulta de diferentes procesos metabólicos, y deriva del metabolismo normal de la metionina. Por ello la cisteína es dependiente de la metionina (aminoácido esencial), ya que se produce siempre que haya metionina suficiente, y un déficit de metionina causaría a su vez menor síntesis endógena de cisteína.
El reciclaje de una gran parte de la homocisteína resultante a metionina nuevamente es imprescindible, y cuando no ocurre correctamente es cuando la homocisteina se acumula en sangre. En este proceso participa tanto la B12 como la B9 y la B6 (ésta última en otra vía, encargada de transformar la homocisteína a cisteína; recordemos el gráfico de las flechitas visto anteriormente). Existe otra vía que lleva a cabo este proceso que emplea la enzima betaína. Por tanto, y simplificando el proceso, el metabolismo de la metionina deriva en homocisteína, y gran parte de ésta debe reconvertirse posteriormente en metionina otra vez. Si algo falla en este proceso (por ejemplo, falta de B12, B9 o una combinación de ambas) se acumula homocisteína en sangre.
A día de hoy sabemos de la importancia de un marcador como la homocisteína sérica, cuyos niveles elevados (hiperhomocisteinemia) están relacionados con:
De manera general en las analíticas estándar y comunes no aparece. El paciente debe pedirla expresamente al médico si éste no la contemplara.
Existe la discusión de si es la homocisteína en sí quien produce dichos problemas o bien los factores subyacentes que han llevado a elevar esta homocisteína. Sea como sea, lo que está claro es que hay correlaciones establecidas con bastante peso a nivel de evidencia (relación potencialmente causal), y bien sea debido a ella directa o indirectamente, su incremento es un dato a tener muy en cuenta y no debe obviarse.
Una homocisteína elevada no necesariamente es concluyente de la existencia de un déficit de B12 o B9 y habría que ponerlo en contexto. Hay otros factores que pueden ser causa de hiperhomocisteinemia o de riesgo para padecer ese aumento, entre los más habituales:
También se sabe que la homocisteína se encuentra aumentada en cuadros de osteoporosis. Pero, si tomamos B12 y ácido fólico, y con ello bajamos a la homocisteína... ¿disminuye el riesgo de fractura? La respuesta nuevamente es que no. Bajar la homocisteína mediante vitaminas no hace que el riesgo de fractura existente baje. Sí que parece, al menos un ensayo clínico de Clements et al así lo sugiere, que si hay niveles bajos de B12 presente, la suplementación sí podría mejorar la densidad mineral ósea.
La vitamina B12 baja tiene asociaciones recientes con cuadros de migraña crónica, y una homoscisteína alta, con los cofactores bajos y alteraciones en la MTHFR (recordemos, la que permitía el paso de THF a M-THF), se ha visto relacionado con la migraña con aura, por una incorrecta síntesis de metionina, que acaba derivando en aumento de homocisteína y ésta provocando un aumento de las especies reactivas de oxígeno (provocando estrés oxidativo).
Ácido metilmalónico
En la conversión de Metilmalonil CoA a Succinil CoA, donde la adenosilcobalamina juega un papel fundamental como cofactor, existiendo un defecto en dicha reacción si no hay suficiente vitamina B12. Este defecto conlleva un bloqueo en la conversión que deriva en la acumulación de ácido metilmalónico (MMA), un producto del proceso responsable de los efectos neurológicos que pueden empezar a aparecer en un momento determinado. Este es otro de los marcadores importantes a contemplar en una analítica. De hecho, es el considerado como estándar de oro en las analíticas al ser el más específico y válido.
Importante: También cuando hay problemas renales puede elevarse el MMA. En población anciana suele verse con facilidad un ácido metilmalónico elevado, ya sea porque se absorbe peor la B12 (puede ser uno de los motivos), o bien que no necesariamente haya deficiencia de B12 como tal, pero sí una alteración de la función renal; por eso es importante revisar el filtrado glomerular, ya que una peor función de la función renal o la enfermedad renal incrementa el MMA, debiéndose tener en cuenta si se hace un cribado con MMA.
4. DEFICIENCIA DE VITAMINA B12
4.1. POBLACIÓN VEGETARIANA ESPAÑOLA: B12 Y ÁCIDO METILMALÓNICO
En 2018 se llevó a cabo el primer estudio evaluando estatus de B12 + Ácido Metilmalónico en población vegetariana española.
La muestra fue de 103 personas de Madrid, aprox. 50% veganos y 50% ovolactovegetarianos. Una muestra no demasiado grande, pero con buen criterio de inclusión en cuanto a hábitos dietéticos se refiere (por ejemplo, no podían consumir carne ni pescado ocasionalmente, cosa que en otros estudios sí se permite y consideran vegetariano a quien lo haga).
Más del 75% de personas tuvieron valores bajos de ácido metilmalónico (el mejor indicador de deficiencia de B12), lo cual indicaría que se estaban suplementando y fuera de peligro (o bien también que no llevaban suficiente tiempo sin suplementación como para que se elevara), pero en 11 de los voluntarios (5 OLV y 6 veganos) los niveles estuvieron por encima del punto de corte establecido, de los cuales 10 tenían niveles plasmáticos de B12 "en rango", lo que estaría indicando un déficit subclínico a pesar de tener una B12 en la analítica aparentemente correcta. Adicionalmente, 2 sujetos más tuvieron niveles de B12 plasmáticos bajos.
El hecho de que en el grupo de OLV aparecieran también niveles disparados de metilmalónico indica, una vez más, que están igualmente en una posición de riesgo potencial, y que muchos de ellos no se suplementan y/o creen cubrir sus requerimientos a partir de alimentos.
A nivel estadístico, en la muestra estudiada 1 de cada 10 tenía deficiencia subclínica.
Las limitaciones del estudio es una muestra no muy grande, no conocer las dosis de suplementación utilizadas (aunque sí la frecuencia), no saber cuánto tiempo en seguimiento de dieta vegetariana llevaban los participantes y que hubo muchos más consumidores de suplementos (75%) que no-consumidores; esto último podría estar hablando de una mejor concienciación al respecto de suplementarse, de hecho se reconoce en el estudio que la gran mayoría de quienes fueron reclutados para participar estaban concienciados de que deben suplementarse.
Apuntemos un dato más, y es que es posible que más de uno empezara en ese momento y mejorara el estatus, debido a que iba a participar en un estudio y tomara conciencia en ese momento de la suplementación para que no saliera un resultado negativo. Y lo siguiente: más de uno de los que no se suplementaba y que tuvo resultados normales, a pesar de mostrar buen estatus en este momento, tendrá problemas futuros.
4.2 CANTIDADES DIARIAS RECOMENDADAS "OFICIALES" Y SUPLEMENTACIÓN
Varían mucho según la fuente consultada. Veamos dos tablas, una en base a población española (FESNAD) y la otra usualmente recomendada para población estadounidense pero también utilizada internacionalmente (IOM).
En el documento de revisión y posicionamiento de la EFSA hacen una recopilación de lo que dicen las principales organizaciones internacionales, y finalmente se posicionan muy por encima del resto.
Las CDR/IDR/RDA siempre han sido punto de debate. Ya que una máxima en nutrición es que ingesta no es igual a absorción e influyen múltiples factores; ni todo el mundo tendrá la misma absorción / rendimiento de los nutrientes, y que, en caso de la B12, inicialmente se establecieron las cantidades teóricas para evitar la anemia megaloblástica, pero quizá no para que todo el mundo tenga un buen estatus, y tampoco todo el mundo tiene la misma absorción, ni hace un reparto crononutricional igual..
Y.. volvemos a decir.. no todo es anemia megaloblástica como síntoma. El espectro es muy variado.
Además.. la cantidad final de B12 no es igual en todo el mundo para compensar las pérdidas. Se ha visto en estudios que hay personas que pueden requerir bastante más vitamina B12 que otras.
La EFSA se posiciona con cantidades más altas. ¿Por qué? Por principio de precaución después de revisar diferentes estudios y contemplar múltiples factores en juego, entre ellos la variabilidad en la absorción, las pérdidas diarias y la reducción de la tasa de absorción a ingestas altas.
Además, hablan de esos valores propuestos como un mínimo; sugieren que de ahí en adelante. Como ya se ha comentado, en función del tamaño del pool de cobalaminas hay más o menos pérdidas y deberían ser cubiertas si se quieren seguir manteniendo aproximadamente los mismos valores de reserva, y todo esto teniendo en cuenta el porcentaje de absorción:
Nota: Hay personas que pueden requerir más de 2000 mcg, entre 2500-3000 mcg, para mantener unos niveles adecuados de B12 y homocisteína bajos. Esto son cuestiones individuales de la práctica clínica, pero que no deben obviarse (nunca nos quedemos con tablas estandarizadas).
A nivel suplementación para veganos/ovolactovegetarianos: El protocolo semanal suele ser referido como más cómodo, y resulta más barato que el diario.
Además, el semanal sirve también si hubiera malabsorción (ya sea crónica o puntual; aunque se suele utilizar inyectable en general en ciertos casos crónicos).
Los protocolos diarios no sirven en malabsorción, así como tampoco sirve cubrir la dosis de B12 dietética a partir de productos animales o de alimentos fortificados.
En población de más de 65 años se observa cómo es mejor trabajar con macrodosis diarias. En ancianos debe irse con cuidado con los suplementos de folatos innecesarios. No hay muchos estudios al respecto, pero sí se ha visto en lo poco que tenemos que los que tenían deficiencia subclínica no remontaban hasta que tomaban 500 μg por día, lo que sugiere posible dosis de mantenimiento (una vez más, hablando de forma estandarizada, sin poder generalizar).
Si queremos ver un protocolo de mantenimiento sencillo minimalista (para población adulta):
Dosis diaria mediante alimento: con productos de origen animal (no apto para vegetarianos) o productos fortificados, o suplementos a bajas dosis.
Con suplemento semanal, para personas que no consuman B12 dietética (veganos), y ovolactovegetarianos o personas que consuman muy poco alimento de origen animal.
También serviría para personas con cuadros de malabsorción. (previa valoración clínica para decidir en cada caso el mejor protocolo, dosis, y vía de aplicación)
Nota 2: el protocolo diario con suplemento o el protocolo con producto fortificado, no sirven si hay malabsorción por cualquier causa.
4.3 VITAMINA B12 EN OVOLACTOVEGETARIANOS
Los ovolactovegetarianos deberían también suplementarse como complemento y precaución ya que muy posiblemente no todos los días hagan un consumo adecuado. Veamos algunos ejemplos para cubrir los requerimientos según los valores de diferentes posicionamientos en adultos (según valores propuestos por FESNAD, IOM, y EFSA)
 Valores obtenidos y calculados a partir de la Base de Datos Española de la Composición de Alimentos (BEDCA) y de la base de datos USDA.
Valores obtenidos y calculados a partir de la Base de Datos Española de la Composición de Alimentos (BEDCA) y de la base de datos USDA.
Recordemos: Sería ideal repartir en, al menos, dos tomas al día. Son cantidades teóricas; hay diferencias entre individuos
Todo esto es muy teórico, puede haber ovolactovegetarianos que necesiten ingerir más cantidad.
En todo caso, lo prudente sería suplementar. Si algún OLV no va a suplementarse, debe hacer un consumo relativamente alto de productos lácteos y/o huevo, repartidos en diferentes tomas a lo largo del día y monitorizarse el estatus correctamente.
5. SINTOMATOLOGÍA Y DIAGNÓSTICO DEL DÉFICIT DE VITAMINA B12
5.1. DEFICIENCIA DE VITAMINA B12
Niveles bajos e insuficientes de vitamina B12 pueden llevar a anemia megaloblástica (no debemos confundir anemia megaloblástica con anemia perniciosa, no toda anemia megaloblástica es perniciosa), y producir síntomas neurológicos, psiquiátricos, cardiovasculares, gastrointestinales, dermatológicos...
Técnicamente, el término anemia perniciosa se refiere a una deficiencia de B12 por malabsorción por gastritis atrófica, debido a la falta de factor intrínseco o a problemas con su secreción por atrofia de la mucosa gástrica, por ataque autoinmune contra el factor intrínseco y/o por destrucción autoinmune de las células parietales secretoras (como sería el caso de la gastritis atrófica, también de origen autoinmune y que produce aclorhidria, y secundario a algunas enfermedades autoinmunes que pueden predisponer a problemas en mucosa gástrica).
Como dato adicional, un cuadro muy común: cuando existe gastritis atrófica y anemia perniciosa derivada de ella, pueden presentarse problemas en la absorción de hierro, incluso anemias ferropénicas ocultas debido a resultados falseados en analítica a causa de una disfunción de su metabolismo con hierro sérico, ferritina e índice de saturación de transferrina elevados. Debe contemplarse que, de presentarse ese cuadro, se dará un descenso de esos marcadores rápido post-tratamiento con B12, y deberá monitorizarse; aprox la mitad de pacientes con anemia perniciosa con déficit de B12, después de la terapia de remonte con esta vitamina reflejaron una anemia ferropénica en analítica, antes oculta y enmascarada.
Una anemia megaloblástica puede tener origen en una carencia de B12, de B9 o de ambas. Como la B12 y B9 comparten funciones interrelacionadas, la anemia y sus mecanismos son iguales independientemente de la que la esté ocasionando, con la diferencia de que el inicio de la anemia es más tardío ante un déficit de B12.
Aparte de la característica común de una anemia (disminución de glóbulos rojos) la anemia por falta de B12 presenta un proceso de macrocitosis (aumento del tamaño de los glóbulos rojos o eritrocitos) que se manifiesta en el crecimiento anormal de las células sanguíneas (los ya comentados megaloblastos), fruto todo esto de una no maduración de su núcleo y de un incremento de la masa y de la maduración citoplasmática. Por ello se dice que la anemia megaloblástica es una anemia macrocítica. Como detalle, hay que remarcar que también puede haber procesos megaloblásticos que cursen sin anemia.
Una de las características como hemos visto es el aumento de tamaño de los eritrocitos, lo cual se reflejaría en una analítica al medir el VCM (Volumen Corpuscular Medio) en sangre. No obstante, recordemos nuevamente: si hay carencia de B12 pero aporte de folatos altos mediante suplementos o fuentes dietéticas el VCM puede no verse alterado, aplacándose la trampa de folatos al recuperar un balance de folatos más o menos válido, y esto hace que puedan no saltar las alarmas en una analítica básica. Lo que sí se acumularía igualmente es la homocisteína, marcador que no aparece en una analítica estándar y debe pedirse expreso (aunque en caso de tomar ácido fólico puede hacer que se regule algo a la baja). El MMA (ácido metilmalónico) es todavía más específico (considerado el “gold standard” en analítica para el déficit de B12).
Este cuadro descrito es habitual en algunos casos de sujetos veganos, ya que suele haber un consumo adecuado y generalmente alto de folatos por la misma dieta, y esto hace que se salve la trampa de folatos en no pocas ocasiones. Por tanto, el hecho de ver en una analítica el VCM en rango y un conteo correcto de eritrocitos no exime de que exista riesgo de padecer sintomatología no hematológica propia de la carencia de B12 sin que se presente el cuadro de anemia megaloblástica (o puede presentarse en forma leve o muy leve). Además, la analítica de B12 sérica puede dar un valor en rango, pero haber una deficiencia tisular.
De modo que hay ocasiones en las que un déficit de B12 puede cursar sin anemia, sin megaloblastosis y sin sintomatología inicial si hay aporte alto de folatos, lo que aún complica más un diagnóstico precoz y puede empeorar la sintomatología, ya que los síntomas (muchos de ellos graves) podrían aparecer a posterior de manera repentina habiendo sido enmascarado el déficit hasta el momento. De hecho, hay asociaciones de, a menos síntomas hematológicos, más severidad en los neurológicos.
Existen situaciones de sintomatología y daño neurológico que aparecen sin anemia previa. La manera de proceder para descartar un enmascaramiento es no solamente mirar la B12 y los marcadores de anemia, sino determinar como mínimo los niveles de homocisteína, y más específicamente y si se puede los de ácido metilmalónico. En la población ovolactovegetariana también hay alto riesgo de déficit, ya que aunque ingieren productos de origen animal como lácteos o huevo, no suelen cubrir a diario el consumo mínimo, que es alto y además idealmente ha de ir repartido en varias ingestas. Además, se sabe que algunos procesos térmicos, como por ejemplo la pasteurización o el UHT al que se somete gran parte de la leche comercial, generan pérdidas de hasta un 7% de vitamina B12 y hervirla un 30%.
Además, una parte de la vitamina B12 contenida en los alimentos pueden ser análogos, lo cual complica las cosas a este grupo poblacional y no sirve mirar exclusivamente la B12 en analítica (ni tampoco obedecer a los valores mínimos de los rangos de laboratorio actuales). Es cierto que tanto vegetarianos como no vegetarianos pueden tener deficiencia de B12, pero en población No Vegetariana la deficiencia NO tiene un origen dietético, ya que sí se consume la vitamina presente en los alimentos de origen animal, sino que la deficiencia de la vitamina obedece a causas varias de malabsorción o de origen autoinmune donde se detectan anticuerpos contra las células parietales y anti factor intrínseco.
Es decir, la deficiencia de B12 dentro del vegetarianismo sería por ausencia dietética (o insuficiente aporte en caso de tomar bajas cantidades) y por no suplementar. Pero las causas de deficiencia de B12 en otros grupos poblaciones hay que buscarlas en otros contextos, pues sí que toman esta vitamina regularmente a través de la alimentación, pero algo falla (no la absorben bien, no tienen las proteínas de unión necesarias, tienen alguna patología o infección que afecta, no producen suficiente ácido clorhídrico, etc)
Vamos ahora un resumen de esas causas de déficit de B12 producido por causas no dietéticas:
Dentro de la clasificación de las deficiencias encontramos el déficit instaurado, el subclínico, el enmascarado, el asintomático y el funcional.
5.2 FASES PROGRESIVAS DE UN DÉFICIT DE B12

5.3 SINTOMATOLOGÍA DE LA DEFICIENCIA DE VITAMINA B12
Pueden presentarse:
Es importante recordar que las mujeres embarazadas que lleven dietas vegetarianas (que incluyan algo de productos derivados animales como por ejemplo leche y/o huevos) o totalmente vegetarianas estrictas (veganas), deben suplementarse y tener un estatus adecuado en embarazo y lactancia, AÚN estando asintomáticas. Por supuesto, la suplementación no solamente debe ser en etapa de embarazo, sino que debe ser mantenida en el tiempo.
Los síntomas de una deficiencia en el bebé son muy graves. Entre ellos: atrofia cerebral, convulsiones, anemia severa, pancitopenia, daño en la vaina de mielina, y problemas residuales post-tratamiento en el desarrollo cognitivo y psicomotor. Además, la medición de B12 en una analítica de sangre no es un marcador preciso, pudiendo estar sobreestimada, y los valores de rango de laboratorio hace tiempo que se ha demostrado que están desfasados.
Hay muchísimos casos clínicos documentados, variados todos ellos, con multitud de síntomas, combinaciones de varios de ellos y apariciones inciertas, y con respuestas relativamente buenas al tratamiento, pero en ocasiones con consecuencias muy graves si tarda en actuarse: pancitopenia, fallo orgánico, pérdida de visión parcial o permanente no recuperada, infartos y muerte.
Quien sea amante de los casos clínicos seguro que disfruta leyéndolos, pues, aunque lamentablemente tristes (y deseándoles el mejor desenlace y la pronta recuperación a cada uno de ellos) es apasionante la cantidad y variedad de síntomas, así como lo incierto de su aparición, y cómo le afecta a cada persona.
Ralph Carmel, uno de los científicos de la era moderna que más a fondo ha estudiado la B12, nos comenta en uno de sus estudios:
NOTA: Deficiencia NO ES IGUAL A sintomatología (puede haber deficiencia asintomática temporal) y la aparición de síntomas es variable e interindividual.
5.4. ANALÍTICA Y VALORES DE RANGO
Una analítica que contemple únicamente la B12 sérica es incompleta.
Niveles de rango de laboratorio de los principales marcadores implicados (pueden variar según laboratorio):
1. VITAMINA B12, INTRODUCCIÓN Y FUENTES DIETÉTICAS
- 1.1 VITAMINA B12, HISTORIA, DESCUBRIMIENTO Y PRODUCCIÓN
- 1.2. FUNCIONES DE LA VITAMINA B12
- 1.3 FORMAS FISIOLÓGICAS Y NO FISIOLÓGICAS DE LA VITAMINA B12
- 1.4. FUENTES DIETÉTICAS DE LA VITAMINA B12
- 1.5. EL PROBLEMA DE LOS ANÁLOGOS DE LA VITAMINA B12
2. BIOQUÍMICA DE LA VITAMINA B12
3. METABOLISMO DE LA VITAMINA B12
- 3.1. METABOLISMO, TRANSPORTE y almacenamiento DE LA VITAMINA B12
- 3.2 ABSORCIÓN Y DIFERENCIAS ENTRE DOSIS FISIOLÓGICAS Y FARMACOLÓGICAS
- 3.3. HOMOCISTEÍNA Y ÁCIDO METILMALÓNICO
4. DEFICIENCIA DE VITAMINA B12
- 4.1. POBLACIÓN VEGETARIANA ESPAÑOLA: B12 Y ÁCIDO METILMALÓNICO
- 4.2 CANTIDADES DIARIAS RECOMENDADAS "OFICIALES" Y SUPLEMENTACIÓN
- 4.3 VITAMINA B12 EN OVOLACTOVEGETARIANOS
5. SINTOMATOLOGÍA Y DIAGNÓSTICO DEL DÉFICIT DE VITAMINA B12
- 5.1. DEFICIENCIA DE VITAMINA B12
- 5.2 FASES PROGRESIVAS DE UN DÉFICIT DE B12
- 5.3 SINTOMATOLOGÍA DE LA DEFICIENCIA DE VITAMINA B12
- 5.4. ANALÍTICA Y VALORES DE RANGO
- 5.5 VITAMINA B12 MUY ALTA
6. VITAMINA B12, EMBARAZO Y LACTANCIA
7. SUPLEMENTACION DE VITAMINA B12
- 7.1 FORMAS DE VITAMINA B12 EN SUPLEMENTOS: CIANO, HIDROXO, METIL
- 7.2. SUPLEMENTACIÓN ORAL VS PARENTERAL
- 7.3 REACCIONES ADVERSAS
- 7.4 PROTOCOLOS DE REMONTE
- 7.5 PORCENTAJES ABSORBIDOS Y RETENIDOS EN DIFERENTES DOSIS Y RUTAS
8. BIBLIOGRAFÍA
1. VITAMINA B12, INTRODUCCIÓN Y FUENTES DIETÉTICAS
1.1 VITAMINA B12, HISTORIA, DESCUBRIMIENTO Y PRODUCCIÓN
La vitamina B12 es una vitamina hidrosoluble que pertenece a la familia de las vitaminas del grupo B, esencial para una correcta eritropoyesis, síntesis de ADN y mantenimiento del sistema nervioso, entre otras funciones. En la literatura científica aparece también como cobalamina. La vitamina B12 es una cobalamina, formada por 4 anillos pirrólicos (estructura tetrapirrólica) que forman un núcleo corrina en torno a un átomo central de cobalto. Se dice que tiene una estructura corrinoide y, como se verá más adelante, otras estructuras corrinoides presentes en la naturaleza (como por ejemplo las que sirven como factores de crecimiento bacteriano) pueden contabilizarse en una analítica de B12 sérica, sin que éstas sean formas activas, con las limitaciones que ello puede conllevar.
Esta vitamina fue todo un misterio durante el siglo XIX. El doctor Addison observó a mediados de ese siglo un cuadro clínico que bautizó como Anemia de Addison, y que otros médicos posteriormente empezaron a asociar con problemas gástricos. En 1872 Bierner lo bautizó como anemia perniciosa. Los primeros experimentos en animales llevados por Whipple, en la década de los años 20 del siglo XX, sobre enzimas hepáticas, enfermedad hepática y hemoglobina, demostraron que la ingesta de hígado y de sus extractos mejoraba los cuadros de anemia convencional, lo que sirvió para abrir una vía de investigación para la anemia perniciosa, todavía un gran misterio. Minot se interesó mucho por los estudios de Whipple, y la posible aplicación de una dietoterapia con grandes cantidades de hígado a diario, siendo esto un éxito.
William B. Castle hace un importante descubrimiento: el factor intrínseco, y habla de la existencia de un factor extrínseco que debía unirse a éste; posteriormente se supo que ese factor extrínseco era realmente la vitamina B12. Se observó que los pacientes con anemia perniciosa instaurada mejoraban con la ingesta de hígado, y posteriormente se empezaron a administrar extractos concentrados a partir de hígados animales, y que sirvieron durante años como la alternativa más viable para el tratamiento de la enfermedad, hasta que se descubrió que era la vitamina B12 la que revertía los síntomas y se trabajó en su síntesis aislada que tuvo lugar hacia mitad- tres cuartos del siglo XX.
| RESUMEN DE PUNTOS CLAVE EN EL DESCUBRIMIENTO DE LA VITAMINA B12 HASTA SU SÍNTESIS DE LABORATORIO |
| El doctor Addison empezó a investigar sobre una extraña enfermedad que acababa siendo muy grave y mortal: Anemia de Addison.
Bierner en 1872: bautiza como Anemia Perniciosa, y se sospecha asociación a problemas gástricos. George Whipple experimenta con animales: Mejora de anemia con ingesta de hígado. Se abre vía de investigación para la AP, que aprovecha Minot en sus experimentos para observar que el hígado servía para tratar la AP. William Bosworth Castle: Factor Intrínseco y Factor Extrínseco. George Minot, William Murphy y George Whipple: Factor extrínseco o “Factor anti-AP” como tratamiento (por aquél entonces) de la anemia perniciosa: Premio Nobel (1934). Mary Shaw Shorb y Karl August Folkers: Factor extrínseco = vitamina B12. Dorothy Hodking: determina estructura química: Premio Nobel (1964). Tratamiento antiguo: Ingesta de hígado en altas cantidades (aprox. medio kg diario) y jugo de hígado. Se trabajó en un extracto de hígado, más potente y efectivo, inyectable, a finales de los años 20’ A posterior: Síntesis aislada en laboratorio a partir de microorganismos. |
De ahí que en base a estos hechos y a su presencia hepática en no pocas ocasiones se asocie a un origen animal. Y no es incorrecto. La vitamina B12 se encuentra en los alimentos de origen animal (excepto la miel), en cantidades variables según procedencia (animal, y parte del animal; siendo el hígado el lugar más destacado de acumulación, como ya hemos visto).
En realidad, si profundizamos un poco más, tiene origen primario bacteriano (gracias a ello a día de hoy se produce en laboratorio). Los animales deben realizar un aporte adecuado de ella para asegurar su presencia, bien sea a través de la ingesta considerada normal fisiológicamente hablando, es decir, comiendo a otros animales y sus vísceras (aplicado a animales carnívoros), o bien según el tipo de animales comiendo directamente de un entorno/suelo rico en bacterias precursoras. Hay algunas excepciones: los rumiantes pueden producirla en su segundo estómago mediante la microbiota allí presente (con necesidad de un precursor dietético micronutricional, el cobalto), o el pescado a partir de su microbiota productora, mediante la ingesta de fitoplancton, o comiendo otros pescados.
En los animales alejados totalmente de entornos naturales y utilizados por la industria ganadera, se realiza el aporte mediante suplementación: piensos enriquecidos o inyecciones (método más habitual debido a las circunstancias de estabulado-producción y privación de alimentación natural; pero también utilizado en animales con más libertad como profilaxis). El nombre de cobalamina proviene del grupo corrina-cobalto que lo integra, y son los cristales del propio cobalto los que le otorgan su color rojo particular. La biosíntesis microbiana de la vitamina B12 ocurre a través de rutas aeróbicas o anaeróbicas. Se da en bacterias y arqueobacterias. La producción industrial se hace a partir de fermentación microbiana. Algunas de las bacterias más habituales que producen B12:
- Aeróbicas: Pseudomonas dentrificans, Rhodobacter capusulatus, Rhodobacter sphaeroides, Sinorhizobium meliloti.
- Anaeróbicas: Bacillus megaterium, Propionibacterium shermanii, Salmonella typhimurium.
La primera cepa bacteriana utilizada para su síntesis fue el Lactobacillus Lactis Doner, aunque actualmente se sabe que pueden sintetizarla muchas otras bacterias, como Pseudomonas denitrificans y Propionibacterium shermanii, que suelen ser utilizadas en la síntesis de laboratorio para suplementación.
La población vegana solamente puede obtener esta vitamina a partir de suplementos o alimentos fortificados, y es esencial y de vital importancia su aporte en todas las etapas de la vida. Los posibles aportes marginales microbianos directos a partir de tierras, alimentos sucios, estiércol / materia fecal o aguas de ciertos ríos o contaminadas son un sinsentido, a pesar de que algunos círculos de personas han llegado a proponerlos como fuente "interesante" para saltarse la suplementación (hablaremos más delante de ello).
Algunos mamíferos herbívoros tienen producción propia bacteriana y son capaces de reabsorberla; ello ha creado opiniones de que los humanos también son capaces de hacerlo solo por el hecho de ser mamíferos, y aunque hay síntesis en algunas zonas no es reabsorbible al encontrarse lejos del íleon. Además, se ha visto que en muchos casos en esos animales concretos y bajo ciertas condiciones puede no ser suficiente su producción endógena y son a menudo suplementados por protocolo para evitar problemas y optimizar los niveles.
Existe también la creencia popular de que las algas, setas y fermentados contienen B12 en abundancia, pero se trata de análogos inactivos que pueden falsear una analítica y entorpecer el metabolismo de la B12 activa. (Nota: en algunos casos muy específicos y en condiciones determinadas en algunas algas y setas podría haber ciertas fracciones activas, pero son cantidades muy pequeñas que no se han demostrado en ningún momento útiles ni viables como estrategias, y puede seguir habiendo análogos).
Por otro lado, los sujetos ovolactovegetarianos no suelen llegar en muchos casos a las recomendaciones de consumo estipuladas y sigue siendo de aplicación el principio de precaución de suplementar; ya que las cantidades diarias teóricas a consumir de ciertos alimentos no suele ser habitual que se cumplan (e incluso a veces cumpliéndolas puede no haber un buen estatus final por diferentes motivos).
Y no solamente es la cantidad total lo que importa; también son muy determinantes el timing y el reparto, existiendo una crononutrición específica (no es lo mismo comer 6 huevos de golpe, que tomarlos en dos o tres comidas separadas algunas horas entre ellas: aunque la cantidad de B12 teórica sea la misma la absorción será distinta). Además, tendríamos de por medio temas digestivos, genéticos y propios de cada persona (no todos absorbemos, retenemos y almacenamos igual). Podemos aplicar heurísticas de aproximación y métricas sencillas, a nivel promedio general, pero la respuesta final la va a regir la fisiología de cada persona.
La vitamina B12 es una vitamina altamente compleja y muy estudiada; a día de hoy se realizan constantes estudios sobre ella.
1.2. FUNCIONES DE LA VITAMINA B12
- Síntesis y maduración de glóbulos rojos: lo que puede derivar en anemia en caso de carencia, debido a una hematopoyesis ineficaz.
- Síntesis de ADN durante la división celular: es un proceso que requiere de rapidez para garantizar la correcta duplicación del ADN; ante un déficit de B12, de B9 o de ambas, las células no son capaces de duplicar el ADN con éxito y existe un retraso en la división celular, lo que deriva en una alteración de este proceso, estancándose en la fase de crecimiento y siendo incapaz de pasar a la fase de mitosis. La célula crece al no poderse dividir correctamente y esto da lugar a los megaloblastos, presentes en sangre periférica y médula ósea. Los megaloblastos son células sanguíneas gigantes cuyo tamaño es anormal, de ahí el prefijo megalo. Los blastos, la otra parte de la palabra, son células que se encuentran en la médula ósea en un estado de inmadurez, no desarrolladas plenamente y aún sin funcionalidad. En condiciones normales, una vez maduran se transforman en glóbulos rojos o blancos. Si falta B12 pero se da suficiente aporte dietético de vitamina B9 puede no haber megaloblastosis (ya que estamos salvando la trampa de folatos), lo que dificulta su diagnóstico.
- Mantenimiento del sistema nervioso / mielina: La mielina es una sustancia con función protectora que envuelve los axones de algunas neuronas formando vainas, las cuales hacen posible la transmisión de impulsos nerviosos entre el cerebro y la médula espinal. La B12 participa en la preservación de la vaina de la mielina. Una carencia de esta vitamina provoca un trastorno madurativo de los precursores mieloides, y debilitará y alterará la mielina debido al aumento de los niveles de ácido metilmalónico.
- Síntesis de lípidos neuronales y producción de neurotransmisores: el aumento del ácido metilmalónico descrito en el anterior punto nos lleva a que la mielina no puede ser estabilizada correctamente, ya que se forman ácidos grasos anormales, consecuencia de la deficiencia de Succinil-CoA.
- Síntesis de metionina, proteínas y aminoácidos.
- Metilación en el ciclo de la metionina de fosfolípidos, proteínas, mielina, catecolaminas, creatina, carnitina, ADN, ARN.
1.3 FORMAS FISIOLÓGICAS Y NO FISIOLÓGICAS DE LA VITAMINA B12
Podemos dividir a las diferentes formas en las que podemos encontrar la vitamina B12 en dos grupos:
Formas fisiológicas, que funcionan como coenzimas para reacciones metabólicas:
- 5-Desoxiadenosilcobalamina. Es la forma de B12 que aparece almacenada a nivel hepático. Predominante en todos los tejidos. Presente también en las mitocondrias celulares.
- Metilcobalamina: forma en la que se encuentra la B12 en plasma. Una pequeña parte aparece también a nivel celular.
- Cianocobalamina: la forma más habitual de suplementación (oral, sublingual e inyectables). Se transformará en forma fisiológica una vez metabolizada.
- Hidroxocobalamina: Habitual en inyectables.
Otras formas: aquocobalamina, nitritocobalamina.
Todas las formas son compuestos químicos de forma molecular similar relacionados a nivel químico, que tienen función de vitamina. Son distintas formas en las que se puede representar a la vitamina.
1.4. FUENTES DIETÉTICAS DE LA VITAMINA B12
Solamente los productos de origen animal son fuente fiable de B12. En productos vegetales solamente aquellos que se encuentran fortificados (es decir, que han suplementado al producto). Por ejemplo, serían productos fortificados los -mal llamados- cereales “de desayuno” o algunas bebidas vegetales y yogures de soja que vengan con B12 adicionada.
En población vegetariana muchas veces se les anima a consumir productos fortiticados para obtener B12. Hay que tener en cuenta que generalmente son productos procesados y suelen tener altos contenidos en azúcar, y contemplar eso si se va a utilizar esa vía como obtención, pues no parece muy coherente obtener B12 a partir de productos procesados.
Además, suele ser engorroso e incómodo tener que contar/calcular cuantos microgramos entran en cada ración que tomemos, hacer varias ingestas al día para optimizar absorción y que se libere la saturación del FI, etc.
1.5. EL PROBLEMA DE LOS ANÁLOGOS DE LA VITAMINA B12
Los análogos de B12 son estructuras corrinoides que contienen cobalto pero no tienen la actividad de la vitamina, ya que tienen alteraciones en el núcleo corrínico. Tienen poca afinidad por el factor intrínseco.
Problemas de los análogos:
- No actúan como B12 activa.
- No pueden metabolizarse en formas activas.
- Compiten por la absorción de la B12 activa, entre otras cosas debido a que las estructuras corrinoides son utilizadas por bacterias intestinales para su crecimiento.
- Pueden falsear analítica en la medición de la B12 sérica.
El alga espirulina no ha demostrado poder resolver problemas relacionados con la B12. Mucha gente la está tomando pensando que contiene B12 real, cuando realmente va cargada de análogos. Ralph Carmel, uno de los principales investigadores de la vitamina B12, publica un estudio en 1988 con varios sujetos analizados donde se sugiere la relación de que a más cantidad de análogos acumulados mayor riesgo de sintomatología neurológica y que ello podría explicar porqué algunos pacientes no experimentaban síntomas neurológicos (al menos hasta el momento) pero sí anemias.
Hay análogos naturalmente presentes y circulantes, en más o menos cantidad según sujetos, de manera totalmente normal. Hay personas “de serie” con más análogos y otras con menos. Otros alimentos habituales (tanto animales como vegetales) también aportan cantidades pequeñas de análogos que no implican problema.
2. BIOQUÍMICA DE LA VITAMINA B12
2.1. FUNCIONES, REACCIONES METABÓLICAS, CÓMO AFECTA UN DÉFICIT Y LA TRAMPA DE FOLATOS
La vitamina B12 tiene multitud de funciones. También actúa, al igual que muchas vitaminas del complejo del grupo B, como una coenzima. A continuación, se listan las más importantes y se especifica lo que sucede en caso de déficit:
Participa en dos reacciones metabólicas muy importantes:
- Conversión del Metilmalonil-CoA en Succinil-CoA, en las mitocondrias celulares mediante la metilmalonil-CoA mutasa y la adenosilcobalamina como cofactor. La metilmalonil-CoA mutasa es una enzima dependiente de la B12.
El metilmalonil-CoA se forma por la degradación de algunos aminoácidos y ácidos grasos.
El Succinil-CoA es uno de los intermediarios en el Ciclo de Krebs y está implicado en la obtención de energía.
En caso de no haber B12 suficiente el metilmalonil CoA se acumula; es por ello que en un déficit de vitamina B12 aparece el ácido metilmalónico elevado. El metilmalónico es un subproducto del metabolismo del ácido propiónico a través de la enzima metilmalonil coA mutasa.
La conversión de metilmalonil CoA a Succinil-CoA implica a la adenosilcobalamina como cofactor, habiendo en caso de deficiencia de ésta una acumulación del ácido metilmalónico.

- Conversión de Homocisteína a metionina, ocurre en el citoplasma celular mediante la enzima metionina sintasa que requiere de la metilcobalamina como cofactor, resultando en una acumulación de homocisteína en plasma si no hay B12. La metionina es un aminoácido esencial que forma parte de las proteínas, pero además tiene diferentes funciones biológicas: es precursora de la adenosilmetionina que participa en la síntesis de proteínas, creatina y neurotransmisores.

Esta conversión también implica a los folatos, con el metil-tetrahidrofolato como cofactor (Metil-THF, la forma más biodisponible del folato).
Pero... Si hay falta de B12 se acumularía el Metil-THF ("queda atrapado") y no llegaría a su destino final (THF), y se produciría la llamada "trampa de folatos": Lo cual afectaría también a la correcta síntesis de ADN y daría comienzo a un cuadro de anemia megaloblástica (no confundir con ferropénica).
Atención: Suplementarse con folato, e incluso en algunos casos de una ingesta dietética alta en folatos, "evita" o "enmascara" este proceso de trampa de folatos, pero no salva la deficiencia de B12 ni la acumulación de homocisteína (aunque cabe la posibilidad de que ésta aparezca algo más baja en la analítica respecto a no tomar una dieta alta en folatos, al ser los folatos un cofactor que baja la homocisteína; aún así, la homocisteína en analítica es un muy buen indicador de problemas con la B12).
El "salvamiento de la trampa de folatos", o el "no-atrapamiento de los mismos", o que "no se de la trampa de folatos" (lo estamos llamando de diferentes maneras, para tratar de transmitir el concepto), no siempre se da ante las situaciones descritas, pero es algo muy común. La suplementación con ácido fólico sí que se sabe que salva la trampa de folatos; mediante la ingesta dietética ya va a depender de diferentes factores, pero es algo más habitual de lo que se cree.
Si se salva la trampa de folatos podemos no tener signos de anemia por déficit de B12. Esto, aunque parece atractivo, no es positivo, ya que aunque en fases tempranas (e incluso que se pueden alargar), puede no haber síntomas hematológicos y salir las analíticas convencionales estándar bien y sin anemia megaloblástica, sí tendremos problemas muy serios a posterior, ya que no nos libraremos de otro tipo de síntomas de aparición más tardía e incierta. Además, sabemos que a más se salva la anemia, más problemas y severidad a nivel neuropsiquiátrico se presentará (en un plazo incierto, más corto o más largo). Además, podemos tener en los primeros compases síntomas difusos y poco claros, como fatiga general, dolores musculares, amanecer cansados… que se pueden atribuir a muchas otras cosas.
Recordemos: que no haya anemia megaloblástica no quiere decir que no puedan existir problemas con la B12. Los problemas pueden producirse con el paso del tiempo. Una vez se presenta la deficiencia potente y seria, puede no haber anemia, o sí; o aparecer más adelante. Por eso mirar si hay anemia megaloblástica o no en una analítica no es concluyente de que exista deficiencia de B12; pues como hemos visto muchas veces no se da, o se da a posterior pero no en los primeros compases.
Realmente, si nos paramos a pensarlo… sería ideal que un problema con la B12 siempre avisara con una anemia megaloblástica. Daría síntomas en etapas más o menos tempranas, se detecta fácil en analítica... pero no siempre es así.
Vamos a ver la descripción sobre la trampa de folatos que nos da el documento "Interrelación de la Vitamina B12 y Ácido Fólico, del Dr Bernardo Condado Arenas." sobre este particular cuadro clínico que estamos explicando:
En la ausencia de vitamina B12, el folato no puede ser reciclado. Y en la ausencia de folato no se puede llevar a cabo ninguna parte del ciclo. Así la deficiencia de cualquiera detiene el circuito. La deficiencia de vitamina B12 en la reducción de la síntesis de ADN es explicada por la "teoría del atrapamiento de folato como metil-tetrahidrofolato".(...) la metionina sintetasa no puede ser activada y el folato se queda como metil-FH4, lo que causa también un déficit funcional de folato; lo que explica así la anemia megaloblástica". FUENTE: Interrelación de la Vitamina B12 y Ácido Fólico. Dr Bernardo Condado Arenas.
Sabemos cómo ya hemos dicho, que puede salvarse la trampa de folatos (mediante suplementación con ácido fólico, o en ocasiones ante dietas altas en folatos). Al salvar la trampa de folatos, tendremos menos o ningún signo de anemia, pero más complicaciones y potencial en otros síntomas. Y de hecho, si hay anemia por B12, tomando ácido fólico… ¡la salvaremos. Pues aplacamos la trampa de folatos! Pero cuidado porque eso tiene graves consecuencias... Si hay déficit de B12 cursando con anemia no debe tomarse ácido fólico, por mucho que eso nos saque inicialmente del cuadro de anemia.
Muchas veces se pauta ácido fólico ante una anemia megaloblástica; y esto puede ser incorrecto. Es cierto que puede ser causada por problemas o deficiencia con los folatos. Pero estos pueden ser secundarios a problemas con la B12, y en ese caso dar ácido fólico o metilfolato sería un error.
Explicaciones sobre esto:
- "Si toma ácido fólico en vez de cianocobalamina, el ácido fólico le resolverá la anemia pero no los trastornos neurológicos". Fuente: Vademecum. Prospecto de OPTOVITE (inyectable de B12)
- "La administración de ácido fólico a pacientes con deficiencia de cobalamina induce mejoría hematológica, pero empeora el cuadro neurológico" Fuente: de Paz R, Hernández-Navarro F. [Management, prevention and control of megaloblastic anemia, secondary to folic acid deficiency]. Nutr Hosp. 2006
- Como las plantas son carentes de Vitamina B12, un régimen vegetariano total causará deficiencia de cobalamina, pero debido a la alta ingesta de folatos, los signos tenderán a ser más neurológicos que hematológicos. Fuente: Ralph Gräsbeck, 2006.
Y, aunque no nos suplementemos, si tomamos una dieta rica en folatos (frutas, verduras, legumbres, frutos secos...) es posible salvar la trampa de folatos (no siempre tiene por qué suceder plenamente, pero es habitual).
En ese caso, no pasamos por anemia (o quizá podríamos tener en algún caso síntomas muy leves o pasajeros) pero eso no quita que la B12 siga mal, y no evitaremos cuadros clínicos a posterior (de aparición incierta, al corto plazo o al medio/largo). Podemos estar asintomáticos o con síntomas leves y difusos mucho tiempo, o que se presente con severidad. La aparición es incierta y la batería de síntomas muy amplia.
De hecho, sujetos con niveles altos de folatos y bajos de vitamina B12 suelen presentar deterioro cognitivo (trampa de folatos salvada, no signos hematológicos - o leves -, sí neuropsicológicos). - "Si toma ácido fólico en vez de cianocobalamina, el ácido fólico le resolverá la anemia pero no los trastornos neurológicos". Fuente: Vademecum. Prospecto de OPTOVITE (inyectable de B12)
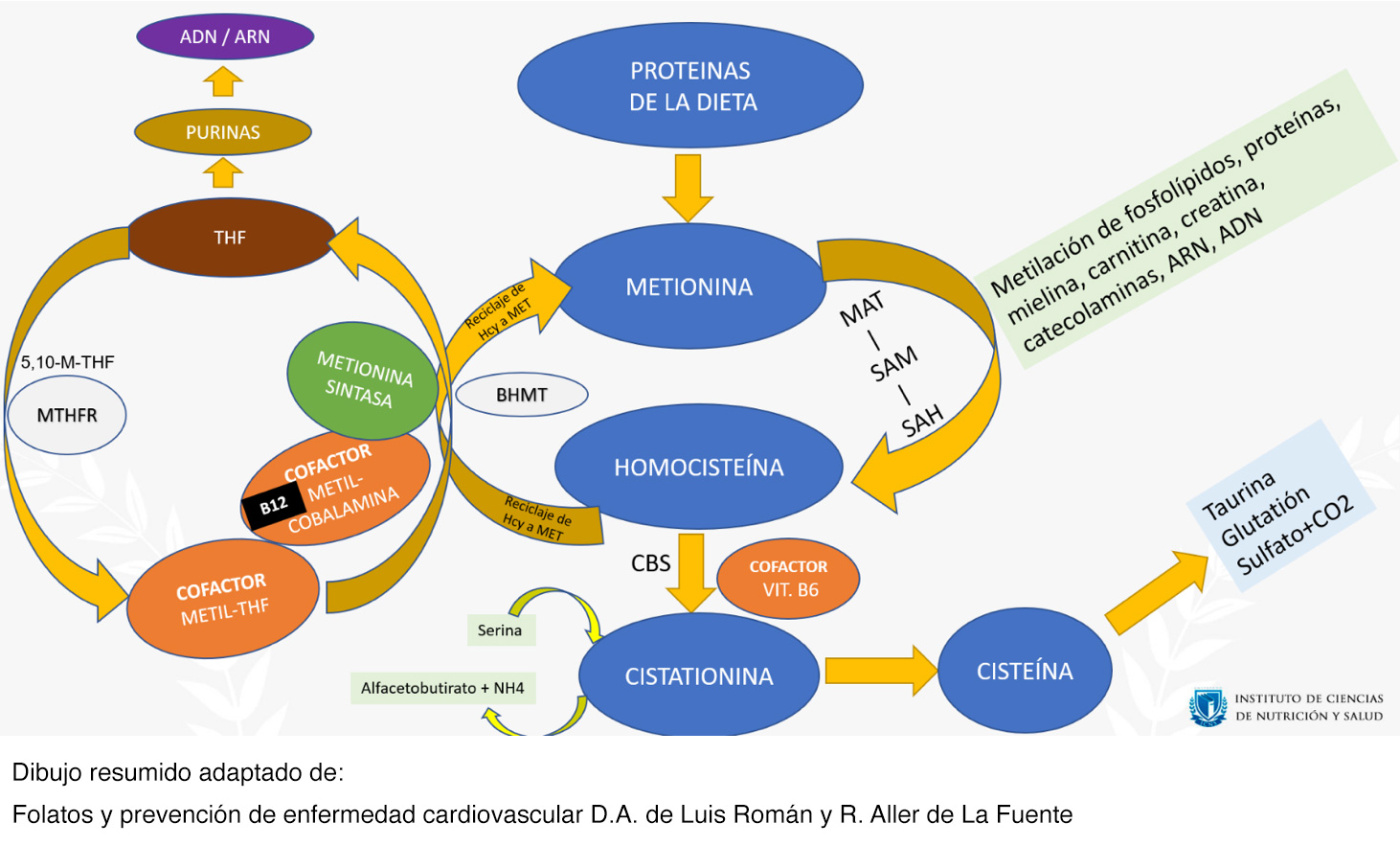
A continuación, vamos a resumir y comentar el circuito completo:

- Ingerimos proteínas de la dieta y obtenemos metionina (MET), un aminoácido esencial (no lo podemos producir, y debe aportarse mediante la alimentación).
- La MET ha de pasar a homocisteína (HCY). Para ello, actúa la MAT (Metionina Adenosil Transferasa), mediante ATP y MET, y se obtiene SAM (S-Adenosilmetionina). Posteriormente pasa de SAM a SAH (S-Adenosilhomocisteína), y finalmente obtenemos Homocisteína.
- Gran parte de la homocisteína ha de reciclarse nuevamente a metionina, y en este punto es donde entran en juego la B12 (en forma metilcobalamina), el METIL-THF y la Metionina Sintasa (que nos permitirá pasar a Metionina).
- No queremos problemas graves Es necesario que todo funcione bien, y tengamos suficiente B12 para activar la Metionina Sintasa. El otro cofactor es el METIL-THF, que debe convertirse a THF (tetrahidrofolato) para que haya una correcta síntesis de ADN.
- Imaginemos que tenemos insuficiente B12: la homocisteína se acumulará de manera anormal, la Metionina Sintasa no funcionará bien, y además podemos tener el fenómeno de la trampa de folatos (el METIL-THF no pasará correctamente a THF!) y tendremos problemas en la división celular y en la síntesis de ADN, que resultarán en procesos megaloblásticos cursantes con anemia; PERO recordemos que ese atrapamiento de folatos puede salvarse en algunas situaciones (recordemos: suplementándonos con ácido fólico, y en bastantes ocasiones también con una dieta rica en folatos). Eso evita los síntomas de anemia o bien hace que sean leves. Y podemos estar asintomáticos mientras todo esto sucede, pero esto no evitará que la B12 siga baja, la Metionina Sintasa funcionando mal y la homocisteína se acumule. Y además sabemos que, a más salvamos la anemia, más severidad en los futuros problemas neurológicos tendremos.
- A partir de la homocisteína también se obtiene cisteína (de hecho, "homo-cisteína" viene de "homólogo de la cisteína"). Esto se realiza en primera instancia obteniendo cistationina (un intermediario de la cisteína), mediante la CBS (Cistationina Beta Sintasa), que usa el factor pirixodal de la vitamina B6 como cofactor, formando cistationina, a partir de la Homocisteína y de la Serina (un aminoácido que participa en la síntesis de purinas y a su vez es precursor de la glicina). Aquí también se produce alfa-cetobutirato (también conocido como ácido alfa-cetobutírico), el cual es considerado un producto de la degradación de la homocisteína, al "romperse" la cistationina. El alfa-cetobutirato participa en la producción de Succinil-CoA.
- Finalmente, este intermediario llamado Cistationina, acaba derivando en cisteína. Por eso la cisteína es un aminoácido que va tan de la mano de la metionina.
- Y mediante la cisteína obtendremos taurina y glutatión.
- El glutatión es un potente antioxidante, con función de protección celular.
- Fijémonos como todo este circuito implica a la síntesis de ADN, síntesis de proteínas, fosfolípidos, mielina, catecolaminas, carnitina, creatina… las implicaciones de que algo falle aquí pueden ser nefastas y peligrosas Podemos tener serios problemas a nivel energético, neurológico, psiquiátrico, cardiovascular...
MTHFR (Metil Tetra Hidro Folato Reductasa): es una enzima del metabolismo de los folatos. Cataliza la conversión de metilentetrahidrofolato (o 5,10-M-THF) a metiltetrahidrofolato (M-THF). El M-THF, recordemos, es un cofactor para degradar la homocisteína y que su paso a metionina sea el correcto. Cuando ingerimos alimentos con la dieta, obtenemos THF, que ha de pasar a M-THF para realizar sus correctas funciones y actuar como cofactor de todo lo que estamos viendo. Si la MTHFR falla o no es capaz de hacer sus funciones plenamente en ese paso, habrá un problema asociado a los folatos. Esto se asocia a temas genéticos. Si se sospecha de ello se puede solicitar analítica de las mutaciones (las habituales son C677T y A1298C).
3. METABOLISMO DE LA VITAMINA B12
3.1. METABOLISMO, TRANSPORTE Y ALMACENAMIENTO DE LA VITAMINA B12
La B12 dietética incluida en los alimentos se encuentra junto a proteínas de unión, de las cuales se liberará en el estómago por la pepsina y la acidez del ácido clorhídrico secretado.
Una vez la B12 se ha liberado de las proteínas dietéticas se une a la haptocorrina salivar, una proteína de unión (también llamada proteína R o cobalofilina) que se secreta en las glándulas salivares y se une en el estómago con la cobalamina, la cual tiene gran afinidad a esta proteína, formando un complejo junto a ella en su paso hacia el duodeno.
Una vez que llega al duodeno, se libera de las proteínas R por la acción de las proteasas y del bicarbonato pancreático, que provocan la eliminación del complejo formado inicialmente, quedando la B12 libre.
Esta vitamina B12, se unirá al factor intrínseco, también conocido como factor intrínseco de Castle en honor al científico William Castle, a quien hemos mencionado anteriormente, y que realizó importantes investigaciones y aportaciones al respecto. El factor intrínseco (FI) es una glicoproteína secretada por las células parietales de la mucosa gástrica que tiene la función de unirse a la vitamina B12 una vez ésta se ha desprendido de las proteínas R, otorgándole resistencia a las proteasas gástricas y pancreáticas, formando un complejo B12+factor intrínseco que se conoce como complejo de Castle. El factor intrínseco tiene una capacidad máxima de unión y se satura sobre los 1.5-2 μg de vitamina B12 ingerida (si tomamos más de esa cantidad, se absorbe menos; y menos cada vez a medida que aumenta la dosis).
En el íleon terminal el complejo de B12+Factor intrínseco se absorbe a través del reconocimiento de unos receptores específicos, que a su vez son los que limitarán la absorción en ingestas fisiológicas o dietéticas. Aquí se libera la cobalamina, y el factor intrínseco se degrada en los lisosomas (orgánulos celulares con enzimas hidrolíticas y proteolíticas).
Si nada de lo anterior ha fallado por el camino, la B12 ha llegado a su primer destino sana y salva; pero todavía le espera un trayecto importante mediante unos transportadores específicos (podemos ilustrarlos como "coches") hasta su destino final.
La B12 libre se une a unas proteínas R de transporte (los coches disponibles) presentes en plasma: las haptocorrinas, también llamadas cobalofilinas o transcobalaminas, de las cuales encontramos la transcobalamina I, II y III.
Hay debate sobre el tema de la I y la III, y si deberíamos hablar en general solamente de la transcobalamina I, o llamarla simplemente haptocorrina. Estas haptocorrinas transportan B12 pero no hacen entrega de la vitamina, tiene alta afinidad por análogos inactivos de B12, aunque se cree que por ello también pueden tener un papel en la eliminación de estos, y otras funciones que están aún en estudio y se desconoce bastante (entre ellas, el transporte de la B12 de almacenamiento).
La transcobalamina II es el "coche" principal y se conoce también a veces como simplemente transcobalamina (TC, o TC2 en según qué textos). Es el transportador más importante, ya que es la encargada del transporte activo de la vitamina y lleva una cantidad aproximada de un 20% (el 80% restante corresponde a la haptocorrina, pero será inactiva).

Muchas células pueden secretar TC, la cual se combina con la B12 libre en las células del íleon para formar holotranscobalamina (holoTC), que ingresa a la circulación portal y será la encargada de entregar la vitamina a las células, ya que transporta la fracción funcional que puede ser absorbida por los tejidos y se libera rápidamente en ellos por endocitosis (proceso de incorporación de moléculas a las células) a través de sus receptores específicos.
Es decir, la transcobalamina-2 (transportador) cargada con B12, es la holo-TC... La cobalamina finalmente se metaboliza en metilcobalamina y desoxiadenosilcobalamina. Entra en el plasma como metilcobalamina y se acumula como reserva en el hígado como desoxiadenosilcobalamina. El 50% (o más, según fuente literaria consultada y según sujeto) de la vitamina B12 se encuentra almacenada en el hígado, y aproximadamente encontramos 1 μg por cada gramo de tejido hepático. También se encuentran grandes cantidades en los riñones. A nivel muscular también hay B12. En la mayoría de tejidos no suele acumularse, sino que se recicla mediante un mecanismo de transporte activo.
Las reservas comprenden rangos de 1-6mg en adultos sanos (incluso pudiendo ser bastante más en el rango superior), siendo lo más habitual en promedio encontrar cantidades de 2-3 mg. Cuanto más grandes sean las reservas más grandes serán las pérdidas diarias normales, y viceversa: a menor pool (reservorio) de cobalaminas, menos B12 será eliminada, lo cual podría ser el resultado de una adaptación metabólica a cuando existen reservas bajas. Es decir, la fisiología de las reservas de B12 es: si tenemos muchas reservas, el organismo sabe que tiene de sobras y no se interesa mucho por salvaguardar y pierde más; y si tenemos pocas reservas, el organismo querrá tratar de ahorrar lo más que pueda (aunque sigue perdiendo igual, pero trata de resistir).
Se estima que cuando el pool corporal es de 300 μg o menos es cuando aparecerían signos de deficiencia. Pero no debe descartarse que puedan existir ya problemas por encima.
Una pequeña parte de la B12 almacenada se secreta continuamente en la bilis. De esa fracción, entre el 50% y el 80% vuelve a seguir los pasos ya comentados (desprenderse de proteínas R y unirse al FI) y es reabsorbido, mientras que el resto se pierde por las heces junto al resto de análogos corrinoides. Es lo que se denomina circulación enterohepática y es por este motivo que una deficiencia por ausencia dietética puede tardar años en darse si hay reservas suficientes aún en ausencia de aporte dietético, puesto que se parte generalmente de un pool alto y pérdidas diarias muy pequeñas si el mecanismo de reabsorción funciona en su punto máximo de eficiencia.
La cantidad de cobalaminas almacenada y cómo funcione el circuito enterohepático y la amortiguación de pérdidas generales a medida que disminuyen los niveles, es muy variable entre sujetos. No todo el mundo pierde igual ni al mismo ritmo. Y tampoco parten de los mismos niveles de reservas.
A más alto sea ese pool inicial, y a más eficiencia tenga la persona en el reciclaje y en la conservación de cobalaminas, más tardará en darse la deficiencia. Esto explica como hay casos que puedan manifestarse en unos meses , o bien en varios años. Y esto explica también cómo hay personas que dicen no haber tenido aún deficiencia en unos años, sin suplementarse y llevando dietas vegetarianas plenas. Ojo con esto.
Si hay aporte dietético o de suplementación y no hay problemas ni alteraciones en la ruta de transporte-absorción-excreción, las pérdidas son compensadas. Si hay ausencia de FI o secreción limitada, no se reabsorbe en el circuito enterohepático y se excreta, con lo cual el déficit llegará antes (pues está fallando el circuito enterohepático de reciclaje), de igual manera que si el aporte dietético no es adecuado llegará un momento donde la circulación enterohepática no será suficiente.
En las heces es donde se encuentra la mayor pérdida. Entre la B12 excretada encontramos la fracción secretada por la bilis que no ha pasado a circulación enterohepática, la que no se ha absorbido de los alimentos y la que ha sido sintetizada en el colon por microorganismos (que no puede ser absorbida ya que no se haya en el íleon ni va a pasar nunca por él). En las heces también se aprecia que una alta cantidad (hasta un 98%) de la B12 excretada son análogos de cobalamina, debido a que ha habido conversión de cobalamina en análogos por parte de microorganismos en el colon.
La otra vía de eliminación es la urinaria, la cual no suele ser destacable excepto cuando se excede la capacidad de unión sanguínea o se utilizan macrodosis a través de suplementación. Debido a la existencia de un reservorio utilizado de manera eficiente mediante el circuito enterohepático, un déficit por ausencia dietética de B12 puede tardar tiempo en presentarse si las reservas son correctas en el momento en el que cesa el aporte de la vitamina. Pero… ¿Cuánto tarda? Es algo indeterminado y dependerá de cada sujeto, reservas previas, gestión de las mismas y eficiencia del circuito enterohepático. Suele situarse en unos 3-4 años aproximadamente, habiendo sujetos donde tenga lugar mucho antes, o después.
3.2 ABSORCIÓN Y DIFERENCIAS ENTRE DOSIS FISIOLÓGICAS Y FARMACOLÓGICAS
El porcentaje de absorción va disminuyendo a medida que la dosis aumenta.
"Cuanta más dosis se toma, menos se absorbe"
En dosis bajas o moderadas, también llamadas fisiológicas, que son las que aportaríamos a través de la alimentación, (aunque podríamos meter aquí también la B12 aportada por alimentos fortificados, o suplementación en cantidades muy pequeñas), la absorción depende del factor intrínseco secretado y de los receptores intestinales del complejo de Castle, que son quienes regularán la absorción. Hay un mecanismo de absorción que en condiciones normales se satura aproximadamente sobre los 1.5-2 μg por comida. Si se excede esa cantidad en una sola toma, la absorción se vuelve dependiente de mecanismos pasivos y difusos, con muchísima menos eficiencia.
Regla sencilla: toda dosis en una sola toma mediante alimentos que exceda la capacidad de saturación del FI, se absorberá muy mal. Y si no producimos FI, imagínense. Se estima que en un período de entre 4-6 horas se recupera plenamente la capacidad de saturación, permitiendo una nueva dosis a igualdad de absorción y de capacidad de saturación que la anterior.
¿Cuánto absorbemos? Se resume que, en condiciones ideales y si la secreción de factor intrínseco es correcta, se absorbe aproximadamente una fracción del 50% por comida realizada. La EFSA en su último consenso recomienda por principio de precaución contemplar una absorción media estimada de un 40% por la cantidad de factores que pueden influir.
Por cada toma de 1 μg de B12 se absorbería aprox. ese 40-50%, pero recordemos que, si la toma es mayor, cada vez se absorbe menos, y que hay también un mecanismo de saturación y debe pasar un período de “recuperación” para que éste sea pleno nuevamente; por ello, hay autores que prefieren ser conservadores en cuanto no sobreestimar la absorción, y contemplar que no todos los alimentos tienen la misma tasa de absorción, ya que cuanto más rico sea en B12 menos se absorberá...
Ya fuera de las dosis bajas, al optar por protocolos con macrodosis de suplementación semanal o por dosis de remonte, debemos hacer un aporte muy alto de B12 para asegurarnos cubrir la absorción de una fracción pequeña pero suficiente, aún a expensas de que la inmensa mayoría de B12 del suplemento acabe no aprovechándose y sea eliminado debido a la menor eficiencia de absorción que encontramos por esta vía al no ser dependientes del factor intrínseco. El ejemplo puesto son las llamadas macrodosis o también conocidas como dosis farmacológicas, que solamente pueden ser aportadas a través de suplementos.
Este es el motivo por el cual, a principio de siglo XX, cuando se descubre que comer hígado mejoraba a los pacientes con anemia perniciosa, tenían que comer ingentes cantidades para lograr un "efecto farmacológico".
En estos casos, nos encontramos con una absorción aproximada de, con suerte, entre un 1-2% de la dosis aportada, pero no es raro que pueda llegar a ser incluso inferior (0,5%) según el tamaño de la dosis, reservas previas y otros factores y condiciones individuales de cada sujeto.
Ante estas dosis farmacológicas o macrodosis se acaba excretando en orina el excedente resultante, que no ha podido unirse ni al factor intrínseco ni unirse plenamente a la transcobalamina debido a que ha excedido la capacidad de unión en la proteína de transporte al encontrarse en dosis muy altas (dosis que habrá sido necesaria, no obstante, para asegurar una absorción determinada según objetivo y finalidad).
Las macrodosis de vitamina B12 se absorben incluso en ausencia de factor intrínseco y de ácido clorhídrico al no ser dependientes, por lo que son la estrategia válida de mantenimiento o remonte en procesos o estados donde no se está secretando esta proteína protectora, en gastrectomías, aclorhídrias, etc.

¿Cuánto duran las reservas? Desde meses a años. Dependerá de varios factores:
- Reservas iniciales.
- Cantidad de FI secretado.
- Eficiencia individual del circuito enterohepático.
- Capacidad de mantener un pool de cobalaminas alto más tiempo.
- Tolerancia y manejo de reservas bajas.
- Presencia o no de problemas gástricos o de malabsorción.
- Medicación paralela (metformina, omeoprazol... interfieren).
- Posibles adaptaciones metabólicas y fenotipos con buena gestión.
- Aportes marginales en zonas tercermundistas (aguas fecales y contaminadas, falta de higiene...).
3.3. HOMOCISTEÍNA Y ÁCIDO METILMALÓNICO
Como hemos visto, en una anemia por carencia de B12 se encuentran elevadas tanto la homocisteína como el ácido metilmalónico, mientras que en una carencia de B9 (también causa de anemia megaloblástica) solamente es la homocisteína la que presenta niveles plasmáticos por encima de lo normal.
Homocisteína
La homocisteína es un homólogo del aminoácido cisteína que resulta de diferentes procesos metabólicos, y deriva del metabolismo normal de la metionina. Por ello la cisteína es dependiente de la metionina (aminoácido esencial), ya que se produce siempre que haya metionina suficiente, y un déficit de metionina causaría a su vez menor síntesis endógena de cisteína.
El reciclaje de una gran parte de la homocisteína resultante a metionina nuevamente es imprescindible, y cuando no ocurre correctamente es cuando la homocisteina se acumula en sangre. En este proceso participa tanto la B12 como la B9 y la B6 (ésta última en otra vía, encargada de transformar la homocisteína a cisteína; recordemos el gráfico de las flechitas visto anteriormente). Existe otra vía que lleva a cabo este proceso que emplea la enzima betaína. Por tanto, y simplificando el proceso, el metabolismo de la metionina deriva en homocisteína, y gran parte de ésta debe reconvertirse posteriormente en metionina otra vez. Si algo falla en este proceso (por ejemplo, falta de B12, B9 o una combinación de ambas) se acumula homocisteína en sangre.
A día de hoy sabemos de la importancia de un marcador como la homocisteína sérica, cuyos niveles elevados (hiperhomocisteinemia) están relacionados con:
- Riesgo cardiovascular y aterosclerosis.
- Enfermedades cerebrovasculares.
- Daño de las células neuronales y enfermedades neurológicas: Alzheimer, Parkinson, demencia.
- Arteriopatía periférica (endurecimiento de las arterias y disminución de flujo sanguíneo).
- Estenosis carotídea (estrechamiento de las arterias carótidas, que son los vasos principales que proporcionan flujo de sangre al cerebro).
- Complicaciones en el embarazo (defectos del tubo neural, abortos de repetición, preeclampsia, retraso del crecimiento intrauterino).
- Mayor riesgo de osteoporosis.
De manera general en las analíticas estándar y comunes no aparece. El paciente debe pedirla expresamente al médico si éste no la contemplara.
Existe la discusión de si es la homocisteína en sí quien produce dichos problemas o bien los factores subyacentes que han llevado a elevar esta homocisteína. Sea como sea, lo que está claro es que hay correlaciones establecidas con bastante peso a nivel de evidencia (relación potencialmente causal), y bien sea debido a ella directa o indirectamente, su incremento es un dato a tener muy en cuenta y no debe obviarse.
Una homocisteína elevada no necesariamente es concluyente de la existencia de un déficit de B12 o B9 y habría que ponerlo en contexto. Hay otros factores que pueden ser causa de hiperhomocisteinemia o de riesgo para padecer ese aumento, entre los más habituales:
- Déficit de vitamina B6 o piridoxina: esta vitamina también interviene en el metabolismo de la metionina y en la síntesis y degradación de la homocisteína. Su déficit es raro. Se encuentra en legumbres, frutas, frutos secos, cereales, vísceras, carne y pescado.
- Problemas metabólicos.
- Hipotiroidismo.
- Sedentarismo.
- Deterioro o alteración de la función renal, ya que el riñón juega un papel vital en el catabolismo de la homocisteína.
- Hepatopatías graves, sobre todo las alcohólicas y cirróticas, ya que suelen presentar deficiencia de folatos y presentan una reducción de las enzimas encargadas del metabolismo de la homocisteína.
- Fármacos, en muchos casos debido a su capacidad de alteración de las concentraciones de las vitaminas implicadas en el metabolismo de la homocisteína. Ejemplos: antiepilépticos, metotrexato, teofilina, óxido nitroso.
- Suplementación con metionina en altas cantidades.
- Enfermedad de Alzheimer.
- Enfermedades inflamatorias crónicas.
- Neoplasias (benignas o malignas).
- SIDA.
- Órganos trasplantados.
- Estrés oxidativo (desequilibrio celular por aumento de radicales libres y disminución de antioxidantes que puede provocar daño tisular).
- Defectos genéticos.
- Presencia de oxisteroles en sangre (óxidos de colesterol).
- Uso de drogas (incluyendo alcohol y tabaco).
- Factores genéticos, algunos medicamentos o los ya comentados déficits de B9 y B6 (algo muy extraño en vegetarianos excepto si existiera un síndrome de malabsorción).
- Suele verse más elevada en sexo masculino, menopausia y vejez.
También se sabe que la homocisteína se encuentra aumentada en cuadros de osteoporosis. Pero, si tomamos B12 y ácido fólico, y con ello bajamos a la homocisteína... ¿disminuye el riesgo de fractura? La respuesta nuevamente es que no. Bajar la homocisteína mediante vitaminas no hace que el riesgo de fractura existente baje. Sí que parece, al menos un ensayo clínico de Clements et al así lo sugiere, que si hay niveles bajos de B12 presente, la suplementación sí podría mejorar la densidad mineral ósea.
La vitamina B12 baja tiene asociaciones recientes con cuadros de migraña crónica, y una homoscisteína alta, con los cofactores bajos y alteraciones en la MTHFR (recordemos, la que permitía el paso de THF a M-THF), se ha visto relacionado con la migraña con aura, por una incorrecta síntesis de metionina, que acaba derivando en aumento de homocisteína y ésta provocando un aumento de las especies reactivas de oxígeno (provocando estrés oxidativo).
Ácido metilmalónico
En la conversión de Metilmalonil CoA a Succinil CoA, donde la adenosilcobalamina juega un papel fundamental como cofactor, existiendo un defecto en dicha reacción si no hay suficiente vitamina B12. Este defecto conlleva un bloqueo en la conversión que deriva en la acumulación de ácido metilmalónico (MMA), un producto del proceso responsable de los efectos neurológicos que pueden empezar a aparecer en un momento determinado. Este es otro de los marcadores importantes a contemplar en una analítica. De hecho, es el considerado como estándar de oro en las analíticas al ser el más específico y válido.
Importante: También cuando hay problemas renales puede elevarse el MMA. En población anciana suele verse con facilidad un ácido metilmalónico elevado, ya sea porque se absorbe peor la B12 (puede ser uno de los motivos), o bien que no necesariamente haya deficiencia de B12 como tal, pero sí una alteración de la función renal; por eso es importante revisar el filtrado glomerular, ya que una peor función de la función renal o la enfermedad renal incrementa el MMA, debiéndose tener en cuenta si se hace un cribado con MMA.
4. DEFICIENCIA DE VITAMINA B12
4.1. POBLACIÓN VEGETARIANA ESPAÑOLA: B12 Y ÁCIDO METILMALÓNICO
En 2018 se llevó a cabo el primer estudio evaluando estatus de B12 + Ácido Metilmalónico en población vegetariana española.
La muestra fue de 103 personas de Madrid, aprox. 50% veganos y 50% ovolactovegetarianos. Una muestra no demasiado grande, pero con buen criterio de inclusión en cuanto a hábitos dietéticos se refiere (por ejemplo, no podían consumir carne ni pescado ocasionalmente, cosa que en otros estudios sí se permite y consideran vegetariano a quien lo haga).
Más del 75% de personas tuvieron valores bajos de ácido metilmalónico (el mejor indicador de deficiencia de B12), lo cual indicaría que se estaban suplementando y fuera de peligro (o bien también que no llevaban suficiente tiempo sin suplementación como para que se elevara), pero en 11 de los voluntarios (5 OLV y 6 veganos) los niveles estuvieron por encima del punto de corte establecido, de los cuales 10 tenían niveles plasmáticos de B12 "en rango", lo que estaría indicando un déficit subclínico a pesar de tener una B12 en la analítica aparentemente correcta. Adicionalmente, 2 sujetos más tuvieron niveles de B12 plasmáticos bajos.
El hecho de que en el grupo de OLV aparecieran también niveles disparados de metilmalónico indica, una vez más, que están igualmente en una posición de riesgo potencial, y que muchos de ellos no se suplementan y/o creen cubrir sus requerimientos a partir de alimentos.
A nivel estadístico, en la muestra estudiada 1 de cada 10 tenía deficiencia subclínica.
Las limitaciones del estudio es una muestra no muy grande, no conocer las dosis de suplementación utilizadas (aunque sí la frecuencia), no saber cuánto tiempo en seguimiento de dieta vegetariana llevaban los participantes y que hubo muchos más consumidores de suplementos (75%) que no-consumidores; esto último podría estar hablando de una mejor concienciación al respecto de suplementarse, de hecho se reconoce en el estudio que la gran mayoría de quienes fueron reclutados para participar estaban concienciados de que deben suplementarse.
Apuntemos un dato más, y es que es posible que más de uno empezara en ese momento y mejorara el estatus, debido a que iba a participar en un estudio y tomara conciencia en ese momento de la suplementación para que no saliera un resultado negativo. Y lo siguiente: más de uno de los que no se suplementaba y que tuvo resultados normales, a pesar de mostrar buen estatus en este momento, tendrá problemas futuros.
4.2 CANTIDADES DIARIAS RECOMENDADAS "OFICIALES" Y SUPLEMENTACIÓN
Varían mucho según la fuente consultada. Veamos dos tablas, una en base a población española (FESNAD) y la otra usualmente recomendada para población estadounidense pero también utilizada internacionalmente (IOM).
| Edad | IDR (µg) |
| 0-6 meses | 0,4 |
| 7-12 meses | 0,5 |
| 1-3 años | 0,7 |
| 4-5 años | 1,1 |
| 6-9 años | 1,2 |
| 10-13 años | 1,8 |
| 14 años en adelante | 2,0 |
| Embarazo | 2,2 |
| Lactancia | 2,6 |
| Adaptado de: Ingestas Dietéticas de Referencia para Población Española. FESNAD, 2010. | |
| Edad | IDR (µg) |
| 0-6 meses | 0,4 |
| 7-12 meses | 0,5 |
| 1-3 años | 0,9 |
| 4-8 años | 1,2 |
| 9-13 años | 1,8 |
| 14 años en adelante | 2,4 |
| Embarazo | 2,6 |
| Lactancia | 2,8 |
| Adaptado de Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin, and Choline (Institute of Medicine, IOM 1998). NOTA: Este es el posicionamiento más clásico y más citado | |
En el documento de revisión y posicionamiento de la EFSA hacen una recopilación de lo que dicen las principales organizaciones internacionales, y finalmente se posicionan muy por encima del resto.
| Edad | IDR (µg) |
| 0-6 meses | Lactancia Materna |
| 7-11 meses | 1,5 |
| 1-3 años | 1,5 |
| 4-6 años | 1,5 |
| 11-14 años | 3,5 |
| 7-10 años | 2,5 |
| 15 años en adelante | 4 |
| Embarazo | 4,5 |
| Lactancia | 5 |
| Adaptado de Scientific Opinion on Dietary Reference Values for Cobalamin (Vitamina B12) EFSA Panel on Dietetic Products, Nutrition and Allergies. EFSA Journal 2015. | |
Las CDR/IDR/RDA siempre han sido punto de debate. Ya que una máxima en nutrición es que ingesta no es igual a absorción e influyen múltiples factores; ni todo el mundo tendrá la misma absorción / rendimiento de los nutrientes, y que, en caso de la B12, inicialmente se establecieron las cantidades teóricas para evitar la anemia megaloblástica, pero quizá no para que todo el mundo tenga un buen estatus, y tampoco todo el mundo tiene la misma absorción, ni hace un reparto crononutricional igual..
Y.. volvemos a decir.. no todo es anemia megaloblástica como síntoma. El espectro es muy variado.
Además.. la cantidad final de B12 no es igual en todo el mundo para compensar las pérdidas. Se ha visto en estudios que hay personas que pueden requerir bastante más vitamina B12 que otras.
La EFSA se posiciona con cantidades más altas. ¿Por qué? Por principio de precaución después de revisar diferentes estudios y contemplar múltiples factores en juego, entre ellos la variabilidad en la absorción, las pérdidas diarias y la reducción de la tasa de absorción a ingestas altas.
Además, hablan de esos valores propuestos como un mínimo; sugieren que de ahí en adelante. Como ya se ha comentado, en función del tamaño del pool de cobalaminas hay más o menos pérdidas y deberían ser cubiertas si se quieren seguir manteniendo aproximadamente los mismos valores de reserva, y todo esto teniendo en cuenta el porcentaje de absorción:
Nota: Hay personas que pueden requerir más de 2000 mcg, entre 2500-3000 mcg, para mantener unos niveles adecuados de B12 y homocisteína bajos. Esto son cuestiones individuales de la práctica clínica, pero que no deben obviarse (nunca nos quedemos con tablas estandarizadas).
A nivel suplementación para veganos/ovolactovegetarianos: El protocolo semanal suele ser referido como más cómodo, y resulta más barato que el diario.
Además, el semanal sirve también si hubiera malabsorción (ya sea crónica o puntual; aunque se suele utilizar inyectable en general en ciertos casos crónicos).
Los protocolos diarios no sirven en malabsorción, así como tampoco sirve cubrir la dosis de B12 dietética a partir de productos animales o de alimentos fortificados.
En población de más de 65 años se observa cómo es mejor trabajar con macrodosis diarias. En ancianos debe irse con cuidado con los suplementos de folatos innecesarios. No hay muchos estudios al respecto, pero sí se ha visto en lo poco que tenemos que los que tenían deficiencia subclínica no remontaban hasta que tomaban 500 μg por día, lo que sugiere posible dosis de mantenimiento (una vez más, hablando de forma estandarizada, sin poder generalizar).
Si queremos ver un protocolo de mantenimiento sencillo minimalista (para población adulta):
Dosis diaria mediante alimento: con productos de origen animal (no apto para vegetarianos) o productos fortificados, o suplementos a bajas dosis.
- Entre 2 y 4mcg (valor FESNAD - valor EFSA).
- Posicionamientos recientes apuntan más hacia 4-5mcg.
- E idealmente repartidos en al menos dos tomas con 4-6 horas de separación.
- Este protocolo no sirve en personas que no absorban bien la vitamina por cualquier causa.
Con suplemento semanal, para personas que no consuman B12 dietética (veganos), y ovolactovegetarianos o personas que consuman muy poco alimento de origen animal.
También serviría para personas con cuadros de malabsorción. (previa valoración clínica para decidir en cada caso el mejor protocolo, dosis, y vía de aplicación)
- 2000 mcg / semana.
- Importante: Algunas personas pueden requerir 2500-3000 mcg / semana.
- Entre 25-100 mcg / día (en una sola toma). Posicionamientos recientes hablan de hasta 200-250mcg al día (en una sola toma).
- Si se hacen más tomas, se tomaría menos dosis en cada toma. Pero esto no suele realizarse en la práctica.
- Este protocolo no sirve en personas que no absorban bien la vitamina por cualquier causa (hay que trabajar con macrodosis).
Nota 2: el protocolo diario con suplemento o el protocolo con producto fortificado, no sirven si hay malabsorción por cualquier causa.
4.3 VITAMINA B12 EN OVOLACTOVEGETARIANOS
Los ovolactovegetarianos deberían también suplementarse como complemento y precaución ya que muy posiblemente no todos los días hagan un consumo adecuado. Veamos algunos ejemplos para cubrir los requerimientos según los valores de diferentes posicionamientos en adultos (según valores propuestos por FESNAD, IOM, y EFSA)
 Valores obtenidos y calculados a partir de la Base de Datos Española de la Composición de Alimentos (BEDCA) y de la base de datos USDA.
Valores obtenidos y calculados a partir de la Base de Datos Española de la Composición de Alimentos (BEDCA) y de la base de datos USDA. Recordemos: Sería ideal repartir en, al menos, dos tomas al día. Son cantidades teóricas; hay diferencias entre individuos
Todo esto es muy teórico, puede haber ovolactovegetarianos que necesiten ingerir más cantidad.
En todo caso, lo prudente sería suplementar. Si algún OLV no va a suplementarse, debe hacer un consumo relativamente alto de productos lácteos y/o huevo, repartidos en diferentes tomas a lo largo del día y monitorizarse el estatus correctamente.
5. SINTOMATOLOGÍA Y DIAGNÓSTICO DEL DÉFICIT DE VITAMINA B12
5.1. DEFICIENCIA DE VITAMINA B12
Niveles bajos e insuficientes de vitamina B12 pueden llevar a anemia megaloblástica (no debemos confundir anemia megaloblástica con anemia perniciosa, no toda anemia megaloblástica es perniciosa), y producir síntomas neurológicos, psiquiátricos, cardiovasculares, gastrointestinales, dermatológicos...
Técnicamente, el término anemia perniciosa se refiere a una deficiencia de B12 por malabsorción por gastritis atrófica, debido a la falta de factor intrínseco o a problemas con su secreción por atrofia de la mucosa gástrica, por ataque autoinmune contra el factor intrínseco y/o por destrucción autoinmune de las células parietales secretoras (como sería el caso de la gastritis atrófica, también de origen autoinmune y que produce aclorhidria, y secundario a algunas enfermedades autoinmunes que pueden predisponer a problemas en mucosa gástrica).
Como dato adicional, un cuadro muy común: cuando existe gastritis atrófica y anemia perniciosa derivada de ella, pueden presentarse problemas en la absorción de hierro, incluso anemias ferropénicas ocultas debido a resultados falseados en analítica a causa de una disfunción de su metabolismo con hierro sérico, ferritina e índice de saturación de transferrina elevados. Debe contemplarse que, de presentarse ese cuadro, se dará un descenso de esos marcadores rápido post-tratamiento con B12, y deberá monitorizarse; aprox la mitad de pacientes con anemia perniciosa con déficit de B12, después de la terapia de remonte con esta vitamina reflejaron una anemia ferropénica en analítica, antes oculta y enmascarada.
Una anemia megaloblástica puede tener origen en una carencia de B12, de B9 o de ambas. Como la B12 y B9 comparten funciones interrelacionadas, la anemia y sus mecanismos son iguales independientemente de la que la esté ocasionando, con la diferencia de que el inicio de la anemia es más tardío ante un déficit de B12.
Aparte de la característica común de una anemia (disminución de glóbulos rojos) la anemia por falta de B12 presenta un proceso de macrocitosis (aumento del tamaño de los glóbulos rojos o eritrocitos) que se manifiesta en el crecimiento anormal de las células sanguíneas (los ya comentados megaloblastos), fruto todo esto de una no maduración de su núcleo y de un incremento de la masa y de la maduración citoplasmática. Por ello se dice que la anemia megaloblástica es una anemia macrocítica. Como detalle, hay que remarcar que también puede haber procesos megaloblásticos que cursen sin anemia.
Una de las características como hemos visto es el aumento de tamaño de los eritrocitos, lo cual se reflejaría en una analítica al medir el VCM (Volumen Corpuscular Medio) en sangre. No obstante, recordemos nuevamente: si hay carencia de B12 pero aporte de folatos altos mediante suplementos o fuentes dietéticas el VCM puede no verse alterado, aplacándose la trampa de folatos al recuperar un balance de folatos más o menos válido, y esto hace que puedan no saltar las alarmas en una analítica básica. Lo que sí se acumularía igualmente es la homocisteína, marcador que no aparece en una analítica estándar y debe pedirse expreso (aunque en caso de tomar ácido fólico puede hacer que se regule algo a la baja). El MMA (ácido metilmalónico) es todavía más específico (considerado el “gold standard” en analítica para el déficit de B12).
Este cuadro descrito es habitual en algunos casos de sujetos veganos, ya que suele haber un consumo adecuado y generalmente alto de folatos por la misma dieta, y esto hace que se salve la trampa de folatos en no pocas ocasiones. Por tanto, el hecho de ver en una analítica el VCM en rango y un conteo correcto de eritrocitos no exime de que exista riesgo de padecer sintomatología no hematológica propia de la carencia de B12 sin que se presente el cuadro de anemia megaloblástica (o puede presentarse en forma leve o muy leve). Además, la analítica de B12 sérica puede dar un valor en rango, pero haber una deficiencia tisular.
De modo que hay ocasiones en las que un déficit de B12 puede cursar sin anemia, sin megaloblastosis y sin sintomatología inicial si hay aporte alto de folatos, lo que aún complica más un diagnóstico precoz y puede empeorar la sintomatología, ya que los síntomas (muchos de ellos graves) podrían aparecer a posterior de manera repentina habiendo sido enmascarado el déficit hasta el momento. De hecho, hay asociaciones de, a menos síntomas hematológicos, más severidad en los neurológicos.
Existen situaciones de sintomatología y daño neurológico que aparecen sin anemia previa. La manera de proceder para descartar un enmascaramiento es no solamente mirar la B12 y los marcadores de anemia, sino determinar como mínimo los niveles de homocisteína, y más específicamente y si se puede los de ácido metilmalónico. En la población ovolactovegetariana también hay alto riesgo de déficit, ya que aunque ingieren productos de origen animal como lácteos o huevo, no suelen cubrir a diario el consumo mínimo, que es alto y además idealmente ha de ir repartido en varias ingestas. Además, se sabe que algunos procesos térmicos, como por ejemplo la pasteurización o el UHT al que se somete gran parte de la leche comercial, generan pérdidas de hasta un 7% de vitamina B12 y hervirla un 30%.
Además, una parte de la vitamina B12 contenida en los alimentos pueden ser análogos, lo cual complica las cosas a este grupo poblacional y no sirve mirar exclusivamente la B12 en analítica (ni tampoco obedecer a los valores mínimos de los rangos de laboratorio actuales). Es cierto que tanto vegetarianos como no vegetarianos pueden tener deficiencia de B12, pero en población No Vegetariana la deficiencia NO tiene un origen dietético, ya que sí se consume la vitamina presente en los alimentos de origen animal, sino que la deficiencia de la vitamina obedece a causas varias de malabsorción o de origen autoinmune donde se detectan anticuerpos contra las células parietales y anti factor intrínseco.
Es decir, la deficiencia de B12 dentro del vegetarianismo sería por ausencia dietética (o insuficiente aporte en caso de tomar bajas cantidades) y por no suplementar. Pero las causas de deficiencia de B12 en otros grupos poblaciones hay que buscarlas en otros contextos, pues sí que toman esta vitamina regularmente a través de la alimentación, pero algo falla (no la absorben bien, no tienen las proteínas de unión necesarias, tienen alguna patología o infección que afecta, no producen suficiente ácido clorhídrico, etc)
Vamos ahora un resumen de esas causas de déficit de B12 producido por causas no dietéticas:
- Gastritis atrófica, donde la misma atrofia de las paredes de la mucosa gástrica fracasa en la producción de factor intrínseco, causando anemia perniciosa.
- Baja producción, o ausencia, de factor intrínseco.
- Presencia de anticuerpos contra el factor intrínseco.
- Enfermedades autoinmunes a las que suele estar frecuentemente asociada la anemia perniciosa o temas digestivos varios que afectarían a su absorción: diabetes mellitus tipo 1, vitíligo, enfermedad de Addison, hipotiroidismo de Hashimoto, hipertiroidismo (enfermedad de Graves), hipoparatiroidismo, lupus eritematoso sistémico, etc.). De hecho la anemia perniciosa / gastritis atrófica se presenta a veces como autoinmune secundaria en enfermedades autoinmunes primarias.
- Celiaquía.
- Enfermedad de Crohn, donde puede darse daño en mucosa gástrica.
- Resección gástrica.
- Resección del íleon.
- Otros problemas en el íleon .
- Insuficiencia pancreática.
- Hipoclorhidria, aclorhidria (baja o nula producción de ácido clorhídrico).
- Aquilia (falta de pepsina en el jugo gástrico y de ácido clorhídrico).
- Drogas y malabsorción ileal asociada al uso de drogas.
- Alcoholismo.
- Parásitos.
- Sobrecrecimiento bacteriano en intestino delgado (SIBO).
- Algunas infecciones (como por ejemplo por Giardia o Helicobacter Pylori, que pueden comprometer la absorción en el íleon por competencia).
- Síndrome de Zollinger-Ellison.
- Defectos en el lumen.
- Fármacos entre los que destacan: omeprazol y otros inhibidores de la bomba de protones, metformina, colestiramina, azatioprina, neomicina, colchicina, quimioterapéuticos y anticonceptivos orales.
- Anemia perniciosa infantil por defecto genético-hereditario.
- Déficits congénitos específicos en el metabolismo de las cobalaminas y/o de sus transportadores.
- Problemas con los transportadores de B12 o con las proteínas de unión asociadas a la vitamina.
- La edad avanzada se asocia a más riesgo. Mayores de 65 años tienen una prevalencia de deficiencia de un 15% debido a una hipoabsorción por atrofia gástrica. Se sospecha que en muchos casos podría deberse a una infección por Helicobacter Pylori. El cribado por MMA, sobre todo en ancianos, debe siempre ponerse en contexto con el filtrado glomerular para descartar algún problema renal.
Dentro de la clasificación de las deficiencias encontramos el déficit instaurado, el subclínico, el enmascarado, el asintomático y el funcional.
5.2 FASES PROGRESIVAS DE UN DÉFICIT DE B12

5.3 SINTOMATOLOGÍA DE LA DEFICIENCIA DE VITAMINA B12
Pueden presentarse:
- Anemia cursante con megaloblastosis (volvemos a recordar… no siempre tiene por qué darse, o no siempre se da de manera temprana).
- Fatiga, fatiga extrema, amanecer muy cansado.
- Ansiedad.
- Insomnio.
- Visión borrosa.
- Dolores varios (habitual en cuello, hombros y cara).
- Anorexia.
- Glositis.
- Parestesia.
- Ataxia.
- Disfunción neurológica: neuropatía, mielopatía, anormalidades neuropsiquiátricas.
- Mala concentración, disfunción cognitiva, pérdida de memoria al corto plazo, lagunas mentales, espesor mental.
- Síntomas mentales como cambios de personalidad, irritabilidad, alteración de la memoria, espesor mental, depresión, demencia, psicosis con alucinaciones y paranoia, pérdida del juicio, actitudes agresivas, conversaciones sin sentido, trastorno obsesivo-compulsivo.
- Degeneración combinada subaguda.
- Fenómeno de Lhermitte: sensación corriente eléctrica que recorre columna vertebral y extremidades. Muchas veces asociado a degeneración combinada subaguda.
- Lesiones desmielinizantes.
- Taquicardias, arritmias, aterosclerosis, colapso.
- Problemas intestinales, vómitos, dolores abdominales, diarrea, incontinencia urinaria.
- Pérdida de apetito sexual.
- Disfunción eréctil. Peor calidad del esperma.
- Hiperpigmentación de piel y uñas, cambios en pelo y uñas, encanecimiento precoz y otros síntomas dermatológicos. Casos raros post-tratamiento inyectable: rosácea, acné.
- En niños, síntomas neuromusculares, atrofia cerebral (hay casos en adultos también), problemas de desarrollo cognitivo.
- Locura megaloblástica (esquizofrenia paranoide).
- Daño en el nervio óptico.
- Hiposmia, anosmia.
- Cuadros neurológicos y psiquiátricos muy variados.
- Cambio en pelo y uñas.
- Canas prematuras.
- Hiperpigmentación.
- Glositis.
- Vitíligo.
- También problemas dermatológicos en terapia de remonte post-tratamiento: acné, rosácea... (muy raras, no suelen darse).
Es importante recordar que las mujeres embarazadas que lleven dietas vegetarianas (que incluyan algo de productos derivados animales como por ejemplo leche y/o huevos) o totalmente vegetarianas estrictas (veganas), deben suplementarse y tener un estatus adecuado en embarazo y lactancia, AÚN estando asintomáticas. Por supuesto, la suplementación no solamente debe ser en etapa de embarazo, sino que debe ser mantenida en el tiempo.
Los síntomas de una deficiencia en el bebé son muy graves. Entre ellos: atrofia cerebral, convulsiones, anemia severa, pancitopenia, daño en la vaina de mielina, y problemas residuales post-tratamiento en el desarrollo cognitivo y psicomotor. Además, la medición de B12 en una analítica de sangre no es un marcador preciso, pudiendo estar sobreestimada, y los valores de rango de laboratorio hace tiempo que se ha demostrado que están desfasados.
Hay muchísimos casos clínicos documentados, variados todos ellos, con multitud de síntomas, combinaciones de varios de ellos y apariciones inciertas, y con respuestas relativamente buenas al tratamiento, pero en ocasiones con consecuencias muy graves si tarda en actuarse: pancitopenia, fallo orgánico, pérdida de visión parcial o permanente no recuperada, infartos y muerte.
Quien sea amante de los casos clínicos seguro que disfruta leyéndolos, pues, aunque lamentablemente tristes (y deseándoles el mejor desenlace y la pronta recuperación a cada uno de ellos) es apasionante la cantidad y variedad de síntomas, así como lo incierto de su aparición, y cómo le afecta a cada persona.
Ralph Carmel, uno de los científicos de la era moderna que más a fondo ha estudiado la B12, nos comenta en uno de sus estudios:
- "La mayor parte de la deficiencia recién reconocida es de naturaleza subclínica, con un impacto en la salud incierto".
- "La prevalencia ha aumentado al incluir a personas con niveles de "B12 normales", algunos de los cuales son deficientes".
- "La fortificación con ácido fólico de algunos productos/alimentos ha generado inquietudes acerca de las posibles consecuencias neurológicas adversas del folato en personas con deficiencia de B12 no detectada".
| Porcentaje de aparición de síntomas tempranos y habituales |
|
| PORCENTAJES REDONDEADOS Y ADAPTADOS DE: A Kornic, Patricia & M J Harty, Margaret & Grant, Joshua. (2016). Influence of Treatment Parameters on Symptom Relief in Individuals with Vitamin B12 Deficiency. Annual Research & Review Biology. 11. 1-831711. 10.9734/ARRB/2016/31711. |
NOTA: Deficiencia NO ES IGUAL A sintomatología (puede haber deficiencia asintomática temporal) y la aparición de síntomas es variable e interindividual.
5.4. ANALÍTICA Y VALORES DE RANGO
Una analítica que contemple únicamente la B12 sérica es incompleta.
- No discrimina análogos de la B12 activa.
- Hay personas que incluso con niveles bajos reales pueden puntuar más alto que otras personas por la presencia de más análogos circulantes (bien sean exógenos, o porque genéticamente tienen más).
- A veces hay laboratorios que aplican criterios tipo “no procede mirar el nivel de B12” solamente porque ha aparecido el VCM y la Hemoglobina bien, y sin alteraciones en el hemograma, y consideran que como no hay anemia megaloblástica instaurada, la B12 estará correcta. Y ya sabemos que esto es un error importante.
- Puede aparecer B12 normal pero que el mecanismo de transporte no esté siendo saturado y por tanto en ausencia dietética la transcobalamina podría no estar entregando la vitamina a los tejidos (deficiencia tisular) pero los valores sanguíneos seguir apareciendo bien.
- La homocisteína y el ácido metilmalónico son dos factores reconocidos clínicamente como muy buenos indicadores del estatus de vitamina B12, y deberían pedirse (al menos la homocisteína), para establecer mejor el estatus y la severidad de una deficiencia si la hubiera. No olvidemos que también puede haber otras causas, como hemos visto, que pueden alterar las mediciones de homocisteína y ácido metilmalónico, con lo cual habría que poner todo en contexto y tratar y valorar cada caso de manera específica e individualizada. El MMA es una prueba cara y muchas veces podemos toparnos con la negativa o problemas para que accedan a mirarla. La homocisteína a veces también cuesta. A malas, podrían hacerse por privado.
- Los rangos de laboratorio de B12 no son adecuados. Actualmente las fuentes actualizadas hablan de tener unos niveles de al menos 400pg/ml, además de una homocisteína normal.
- No todo es el nivel analítico, sino el estatus de funcionalidad fisiológica en cada persona. Habrá personas que con 270pg/mL puedan estar asintomáticas, o realmente todavía no dándose una deficiencia como tal, y otras personas manifestarán ya ciertos síntomas.
Niveles de rango de laboratorio de los principales marcadores implicados (pueden variar según laboratorio):
- B12: 211-700 pg/ml, valor variable entre laboratorios (otros laboratorios sitúan el límite inferior entre 187pg/mL). A veces el límite superior se marca algo más arriba.
Estos valores inferiores son ya considerados problemáticos, incluso muchas veces por encima ya dan problemas, o podemos permanecer asintomáticos pero con déficit subclínico o con problemas que no asociemos a un bajo estatus de B12, o en la antesala de problemas reales, todo esto como ya sabemos con alta probabilidad de que no se produzca una anemia como tal... así que.. - Mucha precaución con los rangos de laboratorio de B12, se les considera desfasados y poco útiles. La evidencia más actual sugiere que el valor mínimo debería ser más alto; algunos autores consideran que por debajo de 300 pg/ml ya se consideraría deficiencia moderada, subclínica, e incluso se les ha llegado a considerar niveles marginales. Lo ideal es tener unos niveles de al menos 400 pg/ml o más con homocisteína normal, o al menos 300 pg/mL (apurando mucho el margen hacia abajo).
- Sorprendentemente, no es raro que a un paciente le digan que está bien de la B12 porque le sale en 195 , porque el rango inferior es 187. O que le digan que no está mal del todo , si le sale en 170 y el rango inferior es 211. “ Esto lo hemos vivido a nivel clínico de manera recurrente. Además, es incorrecto el proceder a veces de mandar un suplemento con 2.4mcg. Insuficiente totalmente.
- Hay sugerencias para que se revisen los valores de referencia en los laboratorios teniendo en cuenta toda la evidencia acumulada de la B12.
Nota: en Japón trabajan con rangos superiores por estos motivos (500-1300 pg/ml) y porque tienen más consumo de análogos teóricos que contabilizarían.
Nota: Normalmente los rangos de laboratorio van en pg/mL. Pero veces se expresa en pmol/L y no en pg/ml (importante mirar siempre las unidades). Son las dos formas habituales (siendo más usual pg/ml).
- La equivalencia de conversión es que 1 pmol/l equivale a 1.35 pg/ml.
- Por tanto, para pasar de pmol/mL a pg/mL, multiplicamos x 1,35.
- En la página unitslab.com nos ofrecen una calculadora de conversión de los valores habituales de laboratorio, tanto de B12 como de muchísimos otros marcadores.
Homocisteína: <10 µmol/litro. Algunos laboratorios sitúan el punto de corte en 12 e incluso se habla de 15. Como siempre, hay ciertos bailes, pero nos podemos hacer una idea. Algunas propuestas hablan de dar algo más de margen al hombre en el rango superior, ya que los hombres suelen tener niveles de homocisteína algo más altos en general respecto a mujeres). Hay una alta correlación entre la deficiencia de B12 y la hiperhomocisteinemia.
Ácido metilmalónico (MMA), el mejor indicador de deficiencia de B12:
- En sangre: 0.07 a 0.27 micromoles / L (algunos laboratorios llegan a dar por "normal" hasta 0.50 micromol / L, pero suele considerarse punto crítico a partir de 0.30 micromol / L en adelante).
- En orina: por debajo de <3,6 micromol/mol creatina. Rango habitual entre 0.5-3.6.
Valores de rango generales en laboratorio:
- VCM: 80-100 fentolitros.
- HCM: 27-31 pg/célula.
Otras particularidades que podemos encontrar a nivel analítico: lactatodeshidrogenasa (LDH) alta debido a la destrucción de glóbulos rojos, posible aumento de ferritina, bilirrubina, neutrófilos hipersegmentados y cambios en la morfología de los hematíes. En casos graves puede haber también trombocitopenia, leucopenia severa o pancitopenia.
5.5 VITAMINA B12 MUY ALTA
Niveles anormalmente altos/muy altos de vitamina B12, no deben ser pasados por alto. Pueden obedecer a una deficiencia funcional (niveles muy altos pero donde la vitamina no funciona bien), con sobrecaptación y/o sobreliberación, por diversas causas.
Si se dieran niveles altos de cobalamina, deben descartarse algunas patologías que podrían estar subyacentes.
Si se encuentra muy elevada suele ser causado por ciertas patologías o por problemas funcionales relacionados con defectos en la captación de vitamina B12, llevando a sobrecaptación e incluso sobreliberación. Aunque el exceso de suplementación también podría en algunos casos lograrlo.
Algunas causas que pueden dar una B12 elevada en una analítica y que deben descartarse:
- Enfermedades hepáticas en general, incluyendo hepatitis aguda y cirrosis. Se observan niveles elevados de haptocorrinas y disminuidos de TC ya que hay menor síntesis hepática de este transportador.
- Presencia de anticuerpos atacando a la TC2, o una TC2 disfuncional.
- Concentraciones muy altas de haptocorrinas.
- Neoplasias hematológicas.
- Tumores.
- Enfermedades renales, autoinmunes, hepáticas, broncopulmonares, alcoholismo, infecciones.
- Posibilidades benignas: posibles reservas muy altas y análogos circulantes en plasma de manera normal en ese sujeto concreto (debe valorarse y descartar otras situaciones sí patológicas).
Y el apartado que quizá muchos esperaban:
- El uso indiscriminado de suplementos sí que puede dar lugar a niveles elevados de cobalaminas. Consumir suplementos en las dosis conocidas no suele aumentar a niveles muy altos la B12. Puede mejorar el estatus o lograr aumentos significativos o llegar a pasar algo los límites superiores, pero sin que ello suponga algo a nivel patológico. En general sólo mediante inyectables, u orales a dosis altas y sostenidas pueden lograrse niveles circulantes elevados, o bien en casos excepcionales que tengan tendencia a la sobrecaptación, o que tengan problemas hepáticos previos, etc. También es posible autoinmunidad que ataque a la TC2 con dosis muy altas o prolongadas mediante inyectables (en forma hidroxo por lo general).
Andrès et al en un paper que siempre recomendamos a nuestros alumnos sobre exceso de cobalaminas, se comenta que en los niveles muy altos de cobalaminas, hay que descartar deficiencias funcionales, mirar homocisteína y MMA, y buscar la causalidad; si hay enfermedad inflamtoria, desórdenes sanguíneos, problemas renales, enfermedad hepática, neoplasias, y otras situaciones que pudieran provocar esto, así como valorar otra posibilidad: si ha habido suplementación previa, exceso de dosis continuadas, qué dosis, cuánto tiempo,etc.
6. VITAMINA B12, EMBARAZO Y LACTANCIA
6.1 VITAMINA B12 EN EL EMBARAZO Y LACTANCIA
Algunas organizaciones recomiendan solamente un pequeño aumento de B12 dietética en la alimentación, y otras un poco más, habiendo discrepancias entre ellas. Se requiere una acumulación fetal de entre 0.1-0.2 μg por día, por ello algunas organizaciones recomiendan aumentar en 0.2 μg los requerimientos diarios de la madre (pero luego esto, ¿Quién lo lleva matemático con la alimentación?, y ¿sabemos exactamente cuánta B12 tiene cada alimento si hay tantos bailes de cifras en las tablas y tampoco sabemos cuánto absorbe exactamente cada persona?).
La EFSA se posiciona sumando al menos +0.5 μg de incremento (ya que contempla el 40% de la absorción) a su recomendación en adultos de cubrir 4 μg o más. En mujeres lactantes hay una estimación de una secreción de 0.4 μg / día a través de la leche materna, aunque según el grupo poblacional estudiado es variable.
Hay que tener en cuenta que los niños son mucho más susceptibles a padecer una deficiencia bastante más rápida de esta vitamina, puesto que no parten con las reservas de un adulto, y su sintomatología puede ser muy grave e incluso permanecer síntomas una vez tratada. Puede haber hasta daño neurológico en el feto en madres deficientes.
Sobre dietas vegetarianas: toda madre vegana o vegetariana que no se suplemente, o cualquier madre que no aporte una cantidad suficiente a través de su dieta por cualquier otro motivo o presente problemas de malabsorción debe suplementarse de manera imperativa (en casos de malabsorción, recordemos, siempre protocolos con macrodosis).
La lactancia aporta B12 al niño a partir de la leche, siempre que los niveles de la madre sean adecuados.
Para bebés en fase de alimentación complementaria y niños se puede optar tanto por gotas como por comprimidos orales, siempre que estos últimos se trituren totalmente hasta reducirse a polvo, al menos hasta los 3 años mínimo, para evitar atragantamientos.
Sobre B12, vegetarianismo y diferentes situaciones algunos autores han propuesto diferentes tablas y protocolos, en base a los datos y estudios publicados. Veamos unos cuadros adaptados de los publicados por Baroni:

Adaptado de: Baroni L, Goggi S, Battaglino R, et al. Vegan Nutrition for Mothers and Children: Practical Tools for Healthcare Providers. Nutrients. 2018;11(1):5. Published 2018 Dec 20. doi:10.3390/nu11010005
Ampliada con los datos de: Recomendaciones del Comité de Nutrición y Lactancia Materna de la Asociación Española de Pediatría sobre las dietas vegetarianas. Susana Redecilla Ferreiro, Ana Moráis López, José Manuel Moreno Villares, en representación del Comité de Nutrición y Lactancia Materna de la AEP
* Los valores con asterisco de Dosis Semanal se han completado con los valores aportados por la Asociación Española de Pediatría, que propone un cuadro similar. Baroni en su texto no propone esos valores.
** En el valor con doble asterisco de 50μg de Dosis Diaria Única de Madres Embarazadas y Lactantes, Baroni nos dice que tomarla en dos tomas (25+25) puede aumentar la biodisponibilidad de B12.

6.2 VITAMINA B12 EN MADRES Y NIÑOS
Es un punto clave y con importantísimas y vitales funciones. En niños, hemos comentado que la cosa se complica todavía más que en adultos. Pueden sufrir déficits mucho más tempranos y severos de entrada, y está de sobra documentado en la literatura científica mediante casos reportados el desastre que puede suponer para los más pequeños padecer un problema con la B12.
Algunos de estos problemas serían: desórdenes neurológicos, atrofia cerebral, desmielinización, retraso en el desarrollo cognitivo y en el crecimiento,retrasos mentales, falta de reacciones emocionales y comunicativas, falta de sonrisas y disposición para jugar, fatiga extrema, vómitos, temblores y convulsiones, alteraciones de la marcha y de la coordinación motora, anemias megaloblásticas severas, trombocitopenia, pancitopenia, pudiendo llegar hasta el coma, fallo respiratorio y muerte. También se describen: hipotonía, debilidad muscular, falta de respuesta a estímulos, retrasos en el desarrollo del habla, falta de interacción con personas, movimientos involuntarios, hiperpigmentación, agrandamiento del hígado y del bazo, baja densidad mineral ósea .Todos ellos documentados a lo largo de la literatura científica.
La probabilidad de que, después del tratamiento, queden síntomas residuales, es mucho más alta que en adultos. Parece que entre el cuarto y el décimo mes es cuando es más habitual que se presente el cuadro clínico, pero también hay casos reportados antes, así como en niños más crecidos.
7. SUPLEMENTACION DE VITAMINA B12
7.1 FORMAS DE VITAMINA B12 EN SUPLEMENTOS: CIANO, HIDROXO, METIL
Respecto a las diferentes formas de B12, se aconseja siempre suplementarse con cianocobalamina, por ser la forma más estudiada (y al mismo tiempo barata, ya que se produce muy fácilmente en laboratorio), además de ser muy estable y resistente y menos fotosensible.
Tiene seguridad demostrada y la cantidad de cianuro contenida es baja.
La cianocobalamina en ocasiones se ha propuesto como peor fuente debido a que debe ser convertida a las dos formas coenzimáticas (metil y adenosil) antes de poder ser utilizada, pero la realidad es que el cuerpo puede convertir sin problema y de manera eficiente la cianocobalamina en metilcobalamina y adenosilcobalamina.
Es cierto que la metil- puede tener sus usos, sin duda, y no es una forma incorrecta; y también se ha comentado que una vez absorbida se retiene mejor; pero se desconocen de manera precisa las dosis a utilizar. No obstante, bien manejada, quien quiera tomar la forma diretamente metilada es una opción.
Aunque inyectada la metil- es la forma menos común, en algunos estudios recientes se está planteando como opción en algunos casos, como por ejemplo en los primeros compases de la esclerosis lateral amiotrófica, donde en un estudio de Ryosuke et al trabajaban con pinchazos de 50mg diarios (lo cual son dosis extremadamente altas).
La hidroxocobalamina por su parte suele encontrarse normalmente en forma de inyectables, aunque es más habitual también la cianocobalamina inyectable, siendo el Optovite (cianocobalamina) el medicamento más común en España para este uso.
A bajas dosis, desde 1 μg hasta 25 μg, todas las formas se absorben igual. A altas dosis la cianocobalamina se absorbe mejor. La metilcobalamina en forma de suplemento se convierte muy eficientemente y también sin dificultad en adenosilcobalamina. Parece ser que una vez absorbida se retiene mejor, pero también hay que tomar dosis mucho más altas. Actualmente no se saben las dosis necesarias ni se conocen bien del todo aspectos de su metabolismo, y es una forma menos estable.
- Solamente en algunos casos estaría contraindicada la cianocobalamina:
- Personas con problemas renales e insuficiencia renal tienen problemas en el aclaramiento y en la eliminación de cianuro.
- Personas con defectos en el metabolismo del cianuro o que hayan sufrido un envenenamiento con cianuro.
- Fumadores: excretan más cianocobalamina, debido a la afinidad que tiene la cobalamina por el cianuro (por ello el tabaquismo es un factor más de riesgo al afectar al metabolismo de la B12). La presencia de cianuro en el organismo está aumentada en el fumador. Se sabe también que administrando hidroxocobalamina en intoxicados por cianuro se elimina de manera muy eficiente al adherirse a la cobalamina. Esto nos lleva a que si un gran fumador hace aporte de hidroxocobalamina (forma dietética más habitual) puede excretar más cianocobalamina. Por ese motivo, se aconseja utilizar metilcobalamina (algunos han sugerido metilcobalamina combinada con cianocobalamina). No obstante, no hay consenso alguno, solamente hipótesis y recomendaciones.
- Personas que hayan mostrado reacciones adversas a los suplementos de ciano- (aunque suele ser más a inyectables que a orales) e incluso casos raros donde el remonte con inyectables cursa con sintomatología neurológica (en esos casos algunos autores sugieren utilizar cobalamina en forma hidroxo, o bien ciclar hidroxo con ciano).
- Patologías como ambliopía tabáquica o enfermedad de Leber.
- Casos particulares donde el profesional quiera utilizar otro tipo de forma por diferentes motivos o causas.
Entre otros, Leene A. Alane y Carlos Rojas-Fernández hacen una revisión de estudios con varios grupos de pacientes con déficit de B12 por diferentes motivos (entre otros, ausencia dietética, gastritis atrófica, resección del íleon o toma de medicamentos) donde algunos recibían B12 oral y otros parenteral (siempre a altas dosis farmacológicas que iban como mínimo desde los 500 μg hasta los 2000 μg).
Incluso se llega a ver como en uno de los casos la suplementación oral a altas dosis es, como mínimo, igual de eficaz que la parenteral, y se aventuran a decir -en base a un estudio- que incluso superior cuando hablamos de dosis de mantenimiento ya que los niveles de ácido metilmalónico que aún permanecían elevados un poco por encima del margen superior descendieron más lentos en el grupo que recibió inyecciones intramusculares. También supondría un importante ahorro, puesto que los suplementos orales a base de cianocobalamina son mucho más baratos que los preparados inyectables.
Comentan que los pacientes suelen preferir por cuestiones de comodidad y adherencia la toma en forma oral en vez de la inyectable. En el caso de suplementación oral, aparentemente no hay diferencias entre tomarlo sublingual o tragado. Entre otros, Amir Sharabi et al hicieron una comparativa entre la ruta sublingual y la oral (tragada) con dosis de 500 μg.
No obstante, y aunque hay estudios de la efectividad de la suplementación oral a altas dosis cuando hay sintomatología, en cuadros severos de sintomatología neurológica habría que optar por la administración de B12 por vía parenteral hasta que remitan los síntomas y se reestablezcan los niveles normales. En ese caso puede pasarse a suplementación oral de mantenimiento si el paciente lo desea y le es más cómodo, siempre teniendo en cuenta las necesidades personales de cada sujeto y estudiando si puede ser una opción para el caso clínico en cuestión.
En pacientes donde los niveles son bajos cercanos al límite inferior y donde no hay sintomatología, se puede hacer una dosis de remonte mediante suplementación oral. Esta dosis puede variar y va a depender de muchos factores, pero suele proponerse un mínimo de entre 2-4 semanas con 2000 μg /día y luego pasar a mantenimiento si se han remontado bien los niveles. También serviría para personas que llevan tiempo sin suplementarse o no saben qué estatus tienen, aunque siempre es recomendable en cualquiera de los casos hacerse un chequeo previo para valorar.
Ralph Carmel publica en 2008 un paper titulado How I Treat Cobalamin Deficiency, donde habla de su amplia experiencia clínica tratando pacientes con deficiencia de vitamina B12.
Comenta que en dosis de mantenimiento no importa usar cobalamina inyectable mensual u oral diaria (cada uno con sus protocolos y dosis específicas), y es la adherencia del paciente la que importa. Si buscamos optimizar la absorción es mejor realizar la toma del suplemento oral en ayunas o entre comidas que después de una comida, ya que la fracción absorbida es mayor.
Toma oral Absorción μg Ratio % 500 μg en ayunas 2.8-13.4 0.5-2.68 500 μg en presencia de comida 1.8-7.5 0.35-1.5 Adaptado de Carmel, R. (2008). How I treat cobalamin (vitamin B12) deficiency. Blood, 112(6), 2214-2221).
Obsérvese que, aunque en ayunas hay más absorción en promedio, qué gran variabilidad de % hay. Esto nos habla de las diferencias entre individuos en el comportamiento de la vitamina.
En casos con sintomatología neurológica instaurada, y en la línea de otros expertos, habla de tratar mediante inyectables y no con orales. Una inyección de 1000 μg puede hacer que se retengan -en casos muy graves y avanzados- hasta unos 150 μg en la gran mayoría de pacientes. Será el médico quien paute el protocolo, dosis y frecuencia. Propone también realizar un estudio previo antes de empezar el tratamiento en pacientes con anemia y sintomatología.
En la vía inyectable para tratar cuadros sintomáticos se ha visto más efectiva la hidroxocobalamina que la cianocobalamina, aunque Carmel habla de ciclarlas entre ellas. Se sorprende también de la cantidad de vegetarianos que rechazan o son reacios a la suplementación.
Pequeño resumen de algunos puntos del paper de Carmel (que recomendamos leer entero por lo interesante que es):
- Sintomatología neurológica: Tratamiento parenteral. Hidroxocobalamina más efectiva que cianocobalamina en estos casos. Carmel las cicla entre ellas.
- A dosis de mantenimiento: No diferencia entre inyectable y oral (valorar adherencia/preferencia).
- Suplemento oral mejor en ayunas o entre comidas.
Un estudio de Bensky et al que miraba ruta oral VS intramuscular:
- Vio como tanto la terapia con B12 con protocolo oral (oral sublingual en este caso) como intramuscular son válidas para elevar los niveles plasmáticos de esta vitamina.
- Vuelven a comentar lo que otros autores ya han dicho repetidas ocasiones: la terapia intramuscular suele resultar más incómoda y más costosa para los pacientes, además de requerir más visitas clínicas, así como que independientemente de la vía de administración, los pacientes con niveles más bajos responden mejor y más rápido mejorando con más eficiencia los síntomas hematológicos derivados de su carencia (aunque recordemos que en situaciones comprometidas y graves normalmente se va directo a protocolos parenterales).
- Como punto de corte han cogido en el estudio uno superior (300 ng/L o pg/mL) a los valores de rango inferior de laboratorio habituales (200), que vuelve a recordarnos otro problema de dichos rangos, que tienen esos valores marcados actualmente en 200 ng/L e incluso menos. Se sabe que entre 200-300 ng/L puede haber algunos sujetos ya con problemas asociados o estar cociéndose a fuego lento el desastre.
En la terapia de remonte oral/sublingual , su administración diaria; mientras que la intramuscular responde a patrones de administración semanales y posteriormente mensuales (o diario/semanal/mensual según protocolo y caso).
La difusión pasiva, aunque es una vía muchísimo menos eficiente, es la vía adecuada para personas con problemas de malabsorción por cualquier causa (entre otras: gastritis atrófica, gastrectomía, autoinmunidades varias -contra factor intrínseco, contra células parietales, malabsorción asociada a otras enfermedades autoinmunes...-, utilización de fármacos que interfieren...).
En niños con anemia macrocítica, un ensayo clínico por Tandon et al, vio que el protocolo parenteral lograba mejores niveles de B12 y hemoglobina, respecto al protocolo oral.
7.3 REACCIONES ADVERSAS
Dentro de las posibles reacciones adversas, consideradas raras y excepcionales, tenemos:
- Hinchazón de cara, lengua, garganta, mareos, dificultad para respirar, problemas dermatológicos, diarrea.
- Posibilidad de hipocalemia tras tratamiento inicial con inyectables: Observación / Monitorización, especialmente post primera inyección y 48h de control posterior.
- No indicados en alergias o hipersensibilidad al cobalto.
- Arritmias, insuficiencia cardíaca.
- Puede precipitar crisis gotosa en predispuestos.
- Suplementos en forma ciano en personas sensibles a cianuro o con problemas renales...
- Atrofia nervio óptico (acelerado en enfermedad de Leber).
- Diarrea leve transitoria.
- Shock anafiláctico, muerte.
- Dosis muy altas inyectadas (especialmente en forma hidroxo) pueden inducir anticuerpos contra la TC2 y niveles excesivos de B12, describiendo un déficit funcional.
- Reacciones adversas a otros ingredientes.
El acné es referido como un síntoma relativamente común, ante dosis muy altas administradas de golpe. No son raros los casos que refieren acné a posterior de realizar protocolos con dosificaciones altas de B12 diarias (5000-10000mcg en una sola toma).
Respecto a la toxicidad, la cobalamina oral se considera muy segura incluso a altas dosis, pero en declaraciones del mismo Ralph Carmel, “la toxicidad es mínima, pero no del todo inexistente”, y no deben hacerse aportes absurdos e injustificados y menos sostenerlos a largo tiempo, ya que eso sí aumenta el riesgo de padecer problemas asociados.
A menudo se suele leer que los suplementos de B12 no causan problemas, que no existe límite, que puedes tomar toda la que quieras, que si te pasas se elimina por orina porque es hidrosoluble... Esto incluso se ha podido escuchar de profesionales de la salud.
Que el IOM en su momento no estableciera un límite superior (upper level, UL), ya que, como comentaba dicho instituto, "no puede ser determinado debido a falta de datos de efectos adversos", no implica que no los haya.
Aún así - y esto no sabemos por qué suele omitirse por parte de quienes se apoyan en el posicionamiento de 1998 del IOM diciendo que “puedes tomar toda la B12 que quieras”- recomendaban que la fuente de esta vitamina fuera sólo a partir de alimentos para evitar altos niveles de ingesta (aunque lógicamente esto en vegetarianos o en casos de malabsorción de la vitamina no se aplicaría).
Ya hay autores que han alertado contra la "barra libre de suplementación". En palabras de Ralph Carmel: "Personas que realmente necesitan B12 no la incorporan, y aquellos que no la necesitarían (por ej. deportistas) usualmente utilizan altas dosis (2000-5000 mcg/día). No se sabe qué pueden ocasionar dosis tan altas diarias sostenidas en el tiempo. Si una persona anciana tiene niveles bajos de B12, no hay problema en usar 500-1000mcg/ día, pero 5000mcg es ridículo."
Es cierto que los problemas son raros y suelen presentarse más en la vía parenteral que en la oral, y más en formas de B12 que no son cianocobalamina, pero no por ello hay que dar vía libre a la suplementación indiscriminada o ignorar las dosis con las que trabajar y los posibles efectos secundarios en los protocolos de remonte. Hay también una llamada a la cautela a las propuestas de fortificación masiva de alimentos con vitamina B12 de productos y alimentos, pudiendo haber más riesgos que beneficios. Por otro lado, la suplementación con ácido fólico de algunos productos podría agravar los problemas asociados con la B12 en personas con deficiencia no detectada, potenciando la severidad de síntomas neurológicos y psiquiátricos, de aparición incierta y la gran mayoría de veces ya en estados subclínicos.
7.4 PROTOCOLOS DE REMONTE
En los protocolos de remonte, cuando hay estatus bajo, déficit subclínico, asintomático, malabsorción que haya conducido a déficit sin sintomatología severa, anemia megaloblástica instaurada no agresiva o síntomas leves, o bien cuando se busca una repleción general, tenemos, por vía oral:
- 500-1000-2000 mcg / día (oral, dosis variable según caso y protocolo, aunque todas parecen servir a nivel general y no individual se suele optar por lo general por 1000 o 2000) durante tiempo variable (normalmente 4-8 semanas, también sujeto a factores, pudiendo ser además de varios meses), valorar cada situación y dosis, importa contexto, estatus inicial, situación clínica de la persona.
- Mediante inyectable se puede tratar también (ojo, cambian dosis y frecuencia).
- Más adherencia y comodidad para el paciente en estos casos suplemento oral VS inyectable.
Como remonte por vía parenteral, cuando hay anemia perniciosa severa, y síntomas neurológicos, o bien si se busca solo una dosis de mantenimiento, se suele hacer de manera general:
- Fase de repleción: 1000 mcg / día la primera semana + 1000 mcg / semana durante 4-8 semanas posteriores (algunos protocolos no utilizan la fase diaria y pasan directos a la semanal, según caso).
- Fase mantenimiento: 1000 mcg / mes, a modo mantenimiento. Si no se busca remonte previo, ésta es la dosis estándar a seguir de mantenimiento por la vía parenteral (un pinchazo al mes de 1000mcg).
- Nota en anemia megaloblástica o repleción en asintomáticos: puede ser suficiente una primera inyección de 1000 mcg para revertir anemia/repletar niveles y luego ya seguir con 1000 mcg /mes. Esto debe decidirlo el profesional al cargo de cada caso.
- Este es el protocolo estandarizado y con B12 en forma ciano. Algunos autores pueden diferir en el planteamiento, en función de cada caso, ciclar diferentes formas de cobalamina (ciano+hidroxo) e incluso ciclar inyectable+oral.
- Estas son líneas generales. Requiere personalizar siempre cada caso.
- Siempre vía intramuscular / subcutánea profunda (pacientes gastrectomizados).
- Hay casos excepcionales donde puede administrarse por vía intravenosa: trombopenia extrema, algunas soluciones de nutrición.
Se trata de una intervención a doble ciego, sujetos vegetarianos y veganos con niveles marginales (>220 pmol/L) o muy bajos (>150 pmol/L) de vitamina B12, pero sin síntomas.
- Criterio de inclusión: No participan: personas con malabsorción, con patologías, fumadores y bebedores, o que usen suplementos.
- B12 administrada en forma sublingual en forma cianocobalamina.
- La muestra es n=36, divididos en 2 grupos.
- Grupo 1: 50 mcg/día de B12 (350 mcg / semana).
- Grupo 2: 2000 mcg/semana de B12 (1 dosis de 2000 mcg en una toma y el resto de días placebo).
- Prohibido tomar suplementos, productos fortificados, ni análogos (por ej. espirulina).
- Nota: No grupo control (vegetarianos sin suplementarse) ni grupo placebo total, por motivos éticos (sabemos de sobra que no dar B12 a alguien con deficiencia le expone a graves problemas; y al saber qué pasaría, se opta por no dar placebos ni grupos sin suplemento).
- Duración de 3 meses. Ambos grupos mejoran niveles de B12, Hcy, MMA, HoloTC.
- Ambas vías sirven para mejorar estatus de B12.
- Con dosis diaria se logra el objetivo.
- No obstante, el grupo de 2000 mcg/semana tuvo mejoras ligeramente superiores (más eficiente).
- Importante: estudio aplicado a personas sin manifestar síntomas clínicos, solo estatus bajo.
7.5 PORCENTAJES ABSORBIDOS Y RETENIDOS EN DIFERENTES DOSIS Y RUTAS

8. BIBLIOGRAFÍA
A Garrido Pertierra. José María Teijon Rivera. Bioquímica metabólica. 2ºEd. Editorial Tebar.
A Kornic, Patricia & M J Harty, Margaret & Grant, Joshua. (2016). Influence of Treatment Parameters on Symptom Relief in Individuals with Vitamin B12 Deficiency. Annual Research & Review Biology. 11. 1-831711. 10.9734/ARRB/2016/31711.
Adams JF, Ross SK, Mervyn L, Boddy K and King P, 1971. Absorption of cyanocobalamin, coenzyme B12, methylcobalamin, and hydroxocobalamin at different dose levels. Scandinavian Journal of Gastroenterology, 6, 249–252.
Aguirre JA, Donato ML, Buscio M, Ceballos V, Armeno M, Aizpurúa L, Arpí L. [Serious neurological compromise due to vitamin B12 deficiency in infants of vegan and vegetarian mothers]. Arch Argent Pediatr. 2019 Aug 1;117(4):e420-e424.
Al Amin ASM, Gupta V. Vitamin B12 (Cobalamin). 2022 Jun 21. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan–.
Alenzuela B, Alfonso; Sanhueza C, Julio, Nieto K. Susana. Oxidos del Colesterol (oxisteroles): Factores que condicionan su formación, efectos biológicos y su presencia en los alimentoslRev. chil. nutr. 2002, vol.29, n.2, pp.116-124.
Allen RH, Stabler SP. Identification and quantitation of cobalamin and cobalamin analogues in human feces. Am J Clin Nutr. 2008 May;87(5):1324-35.
Andres E, Affenberger S, Vinzio S, Kurtz JE, Noel E, Kaltenbach G, Maloisel F, Schlienger JL and Blickle JF, 2005. Food-cobalamin malabsorption in elderly patients: clinical manifestations and treatment. American Journal of Medicine, 118, 1154–1159.
Andres E, Serraj K, Zhu J and Vermorken AJ, 2013. The pathophysiology of elevated vitamin B12 in clinical practice. QJM- Monthly Journal of the Association of Physicians, 106, 505–515.
Andrès E, Serraj K, Zhu J, Vermorken AJ. The pathophysiology of elevatedvitamin B12 in clinical practice. QJM. 2013 Jun;106(6):505-15. doi:10.1093/qjmed/hct051. Epub 2013 Feb 27. Review.
Ankar A, Kumar A. Vitamin B12 Deficiency. 2022 Jun 5. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan–.
Antoni AC. Megaloblastic anemias. En: Hematology basic principles and practice. 2nd ed. New York: Churchill Livingston,1995:552-86.
Antony AC. Prevalence of cobalamin (vitamin B-12) and folate deficiency in India--audi alteram partem. Am J Clin Nutr. 2001 Aug;74(2):157-9.
Anurag A. A Study on the Levels of Folic Acid, Vitamin B12 and Plasma Homocysteine in Patients with Chronic Kidney Disease. J Assoc Physicians India. 2022 Apr;70(4):11-12.
Aoyama T, Maezawa Y, Cho H, Saigusa Y, Tamura J, Tsuchida K, Komori K, Kano K, Segami K, Hara K, Senuki K, Suzuki Y, Yamakawa M, Tamagawa H, Oshima T, Yukawa N, Rino Y. Phase II Study of a Multi-center Randomized Controlled Trial to Evaluate Oral Vitamin B12 Treatment for Vitamin B12 Deficiency After Total Gastrectomy in Gastric Cancer Patients. Anticancer Res. 2022 Aug;42(8):3963-3970. doi: 10.21873/anticanres.15891.
Arendt JF, Nexo E. Cobalamin related parameters and disease patterns in patients with increased serum cobalamin levels. PLoS One. 2012;7(9):e45979.
Arendt JF, Pedersen L, Nexo E, Sørensen HT. Elevated plasma vitamin B12 levels as a marker for cancer: a population-based cohort study. J Natl Cancer Inst. 2013 Dec 4;105(23):1799-805.
Aslinia F, Mazza JJ, Yale SH. Megaloblastic anemia and other causes of macrocytosis. Clin Med Res. 2006 Sep;4(3):236-41. Review. Erratum in: Clin Med Res. 2006 Dec;4(4):342.
Barney AM, Danda S, Cherian AG, Aronraj J, Jayaprakash L, Abraham VJ, Christudass CS, Marcus TA. Association of methylenetetrahydrofolate reductase (MTHFR) gene polymorphisms with vitamin B12 deficiency and adverse perinatal outcomes among pregnant women of rural South India - a cross sectional longitudinal study. J Perinat Med. 2022 Jul 11. doi: 10.1515/jpm-2022-0119.
Batalha MA, Dos Reis Costa PN, Ferreira ALL, Freitas-Costa NC, Figueiredo ACC, Shahab-Ferdows S, Hampel D, Allen LH, Pérez-Escamilla R, Kac G. Maternal Mental Health in Late Pregnancy and Longitudinal Changes in Postpartum Serum Vitamin B-12, Homocysteine, and Milk B-12 Concentration Among Brazilian Women. Front Nutr. 2022 Jul 11;9:923569. doi: 10.3389/fnut.2022.923569.
Bell DSH. Metformin-induced vitamin B12 deficiency can cause or worsen distal symmetrical, autonomic and cardiac neuropathy in the patient with diabetes. Diabetes Obes Metab. 2022 Aug;24(8):1423-1428. doi: 10.1111/dom.14734. Epub 2022 May 20.
Bensky MJ, Ayalon-Dangur I, Ayalon-Dangur R, Naamany E, Gafter-Gvili A, Koren G, Shiber S. Comparison of sublingual vs. intramuscular administration of vitamin B12 for the treatment of patients with vitamin B12 deficiency. Drug Deliv Transl Res. 2019 Jun;9(3):625-630. doi: 10.1007/s13346-018-00613-y.
Berlin H, Berlin R, Brante G. Oral treatment of pernicious anemia with high doses of vitamin B12 without intrinsic factor. Acta Med Scand. 1968 Oct;184(4):247-58.
Blanco-Vaca F, Deulofeu R, Vilaseca MA, Chacón P, Dulin E. Determinación de homocisteína en plasma: metabolismo, metodología, interpretación de resultados y papel en la evaluación del riesgo cardiovascular. Química Clínica 2002;21:243-50.
Bobat H, Akyol M, Moradi P. Comment on: 'Patients with unexplained neurological symptoms and signs should be screened for vitamin B12 deficiency regardless of haemoglobin levels'. Eye (Lond). 2022 Jul 2. doi: 10.1038/s41433-022-02162-8.
Bondevik GT, Schneede J, Refsum H, Lie RT, Ulstein M, Kvåle G. Homocysteine and methylmalonic acid levels in pregnant Nepali women. Should cobalaminsupplementation be considered? Eur J Clin Nutr. 2001 Oct;55(10):856-64.
Brescoll J, Daveluy S. A review of vitamin B12 in dermatology. Am J Clin Dermatol. 2015 Feb;16(1):27-33. doi: 10.1007/s40257-014-0107-3. Review.
Carmel R, Gott PS, Waters CH, et al. The frequently low cobalamin levels in dementia usually signify treatable metabolic, neurologic and electrophysiologic abnormalities. Eur J Haematol. 1995;54:245–253.
Carmel R, Green R, Jacobsen DW, Rasmussen K, Florea M, Azen C. Serum cobalamin, homocysteine and methylmalonic acid concentrations in a multiethnic elderly population: ethnic and sex differences in cobalamin and metabolite abnormalities. Am J Clin Nutr. 1999;70:904–910.
Carmel R, Green R, Rosenblatt DS, Watkins D. Update on cobalamin, folate, and homocysteine. Hematology. 2003:62–81.
Carmel R, Karnaze DS, Weiner JM. Neurologic abnormalities in cobalamin deficiency are associated with higher cobalamin "analogue" values than are hematologic abnormalities. J Lab Clin Med. 1988 Jan;111(1):57-62.
Carmel R, Melnyk S, James SJ. Cobalamin deficiency with and without neurologic abnormalities: differences in homocysteine and methionine metabolism. Blood. 2003;101:3302–3308.
Carmel R, Sarrai M. Diagnosis and management of clinical and subclinical cobalamin deficiency: advances and controversies. Curr Hematol Rep. 2006;5:23–33.
Carmel R, Sinow RM, Karnaze DS. Atypical cobalamin deficiency: subtle biochemical evidence of deficiency is commonly demonstrable in patients without megaloblastic anemia and is often associated with protein-bound cobalamin malabsorption. J Lab Clin Med. 1987;109:454–463.
Carmel R, Spencer CA. Clinical and subclinical thyroid disorders associated with pernicious anemia: observations on abnormal thyroid-stimulating hormone levels and on a possible association of blood group O with hyperthyroidism. Arch Intern Med. 1982;142:1465–1469.
Carmel R, Weiner JM, Johnson CS. Iron deficiency occurs frequently in patients with pernicious anemia. JAMA. 1987;257:1081–1083.
Carmel R. Cobalamin, the stomach, and aging. Am J Clin Nutr. 1997;66:750–759.
Carmel R. Current concepts in cobalamin deficiency. Annu Rev Med. 2000;51:357–375.
Carmel R. Current concepts in cobalamin deficiency. Annu Rev Med. 2000;51:357–375.
Carmel R. Efficacy and safety of fortification and supplementation with vitamin B12: biochemical and physiological effects. Food Nutr Bull. 2008 Jun;29(Suppl):S177-87. Review.
Carmel R. Efficacy and safety of fortification and supplementation with vitamin B12: biochemical and physiologic effects. Food Nutr Bull. 2008;29(suppl):S177–S187.
Carmel R. How I treat cobalamin (vitamin B12) deficiency. Blood. 2008 Sep 15;112(6):2214-21. doi: 10.1182/blood-2008-03-040253. Epub 2008 Jul 7.
Carmel R. Macrocytosis, mild anemia and delay in diagnosis of pernicious anemia. Arch Intern Med. 1979;139:47–50.
Carmel R. Malabsorption of food cobalamin. Baillieres Clin Haematol. 1995;8:639–655.
Carmel R. Nutritional vitamin B12 deficiency: possible contributory role of subtle vitamin B12 malabsorption. Ann Intern Med. 1978;88:647–649.
Carmel R. Pepsinogens and other serum markers in pernicious anemia. Am J Clin Pathol.
Carmel R. Pernicious anemia: the expected findings of very low serum cobalamin levels, anemia, and macrocytosis are often lacking. Arch Intern Med. 1988;148:1712–1714.
Carmel R. Prevalence of undiagnosed pernicious anemia in the elderly. Arch Intern Med. 1996;156:1097–1100.
Çebi M, Metin B, Tarhan N. The association between vitamin B12 and plasma homocysteine levels with episodic memory and the volume of memory related brain structures in middle-aged individuals: a retrospective correlational study. Brain Struct Funct. 2022 Jul;227(6):2103-2109. doi: 10.1007/s00429-022-02499-6.
Cicero AF, Minervino A. Combined action of SAMe, Folate, and Vitamin B12 in the treatment of mood disorders: a review. Eur Rev Med Pharmacol Sci. 2022 Apr;26(7):2443-2459. doi: 10.26355/eurrev_202204_28479.
Clements M, Heffernan M, Ward M, Hoey L, Doherty LC, Hack Mendes R, Clarke MM, Hughes CF, Love I, Murphy S, McDermott E, Grehan J, McCann A, McAnena LB, Strain JJ, Brennan L, McNulty H. A 2-year randomized controlled trial with low-dose B-vitamin supplementation shows benefits on bone mineral density in adults with lower B12 status. J Bone Miner Res. 2022 Sep 21. doi: 10.1002/jbmr.4709.
Cohen H, Weinstein WM, Carmel R. The heterogeneity of gastric histology and function in food cobalamin malabsorption: absence of atrophic gastritis and achlorhydria in some patients with severe malabsorption. Gut. 2000;47:638–645.
Conocimientos actuales sobre nutrición editado por Ekhard E. Ziegler,L.J. Filer (Jr), V. Herbert.
Cortés MF, Hirsch BS, de la Maza CMP. Importancia del ácido fólico en la medicina actual. Rev Méd Chile. Scielo Chile [en línea] Febrero de 2000 [fecha de acceso Junio de 2007]; 128 (2):
Dagnelie PC, van Staveren WA, van den Berg H. Vitamin B-12 from algae appears not to be bioavailable. Am J Clin Nutr. 1991 Mar;53(3):695-7.
Dagnelie PC, van Staveren WA, van den Berg H. Vitamin B-12 from algae appears not to be bioavailable. Am J Clin Nutr. 1991 Mar;53(3):695-7.
de Paz R, Hernández-Navarro F. [Management, prevention and control of megaloblastic anemia, secondary to folic acid deficiency]. Nutr Hosp. 2006 Jan-Feb;21(1):113-9.
Department of Pediatrics, Chacha Nehru Bal Chikitsalaya, New Delhi, India. Perturbing Status of Vitamin B12 in Indian Infants and Their Mothers. M Mittal et al. Food Nutr Bull 38 (2), 209-215. 2017 Mar 07.
Depuis Z, Gatineau-Sailliant S, Ketelslegers O, Minon JM, Seghaye MC, Vasbien M, Dresse MF. Pancytopenia Due to Vitamin B12 and Folic Acid Deficiency-A Case Report. Pediatr Rep. 2022 Mar 3;14(1):106-114. doi: 10.3390/pediatric14010016.
Depuis Z, Gatineau-Sailliant S, Ketelslegers O, Minon JM, Seghaye MC, Vasbien M, Dresse MF. Pancytopenia Due to Vitamin B12 and Folic Acid Deficiency-A Case Report. Pediatr Rep. 2022 Mar 3;14(1):106-114. doi: 10.3390/pediatric14010016.
Dharmarajan TS, Norkus EP. Approaches to vitamin B12 deficiency. Early treatment may prevent devastating complications. Postgrad Med. 2001 Jul;110(1):99-105; quiz 106. Review.
Dobson R, Alvares D. The difficulties with vitamin B12. Pract Neurol. 2016 Aug;16(4):308-11.
Dror DK, Allen LH. Effect of vitamin B12 deficiency on neurodevelopment in infants: current knowledge and possible mechanisms. Nutr Rev. 2008 May;66(5):250-5. doi: 10.1111/j.1753-4887.2008.00031.x. Review.
D'Souza SW, Glazier JD. Homocysteine Metabolism in Pregnancy and Developmental Impacts. Front Cell Dev Biol. 2022 Jun 30;10:802285. doi: 10.3389/fcell.2022.802285.
Effects of smoking on metabolism and excretion of vitamin B12. J. C. Linnell, A. D. Smith, C. L. Smith, J. Wilson, and D. M. Matthews. Br Med J. 1968 Apr 27; 2(5599): 215–216.
EFSA NDA Panel (EFSA Panel on Dietetic Products, Nutrition and Allergies), 2015. Scientific Opinion on Dietary Reference Values for cobalamin (vitamin B12). EFSA Journal 2015;13(7):4150, 64 pp.
Eussen SJ, de Groot LC, Clarke R, Schneede J, Ueland PM, Hoefnagels WH, van Staveren WA. Oral cyanocobalamin supplementation in older people with vitamin B12 deficiency: a dose-finding trial. Arch Intern Med. 2005 May 23;165(10):1167-72.
Fang H, Kang J, Zhang D. Microbial production of vitamin B(12): a review and future perspectives. Microb Cell Fact. 2017 Jan 30;16(1):15.
Farooq MD, Tak FA, Ara F, Rashid S, Mir IA. Vitamin B12 Deficiency and Clinical Neuropathy with Metformin Use in Type 2 Diabetes. J Xenobiot. 2022 May 31;12(2):122-130. doi: 10.3390/jox12020011.
Ferré N, Gómez F, Camps J, Simó JM, Murphy MM, Fernández-Baelart J, et al. Plasma homocysteine concentrations in patients with liver cirrhosis. Clin Chem 2002;48:183-5.
Forsyth JC, Mueller PD, Becker CE, Osterloh J, Benowitz NL, Rumack BH, Hall AH. Hydroxocobalamin as a cyanide antidote: safety, efficacy and pharmacokinetics in heavily smoking normal volunteers. J Toxicol Clin Toxicol. 1993;31(2):277-94.
Folatos y prevención de enfermedad cardiovascular D.A. de Luis Román y R. Aller de La Fuente.
Folsom AR, Nieto FJ, McGovern PG, et al. Prospective study of coronary heart disease incidence in relation to fasting total homocysteine, related genetic polymorphisms, and B vitamins: the Atherosclerosis Risk in Communities (ARIC) study. Circulation. 1998;98:204 - 210.
Food and Nutrition Board, Institute of Medicine. Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington, DC: National Academy Press; 2000.
Forsyth JC, Mueller PD, Becker CE, Osterloh J, Benowitz NL, Rumack BH, Hall AH. Hydroxocobalamin as a cyanide antidote: safety, efficacy and pharmacokinetics in heavily smoking normal volunteers. J Toxicol Clin Toxicol. 1993;31(2):277-94.
Gallego-Narbón A, Zapatera B, Álvarez I, Vaquero MP. Methylmalonic Acid Levels and their Relation with Cobalamin Supplementation in Spanish Vegetarians. Plant Foods Hum Nutr. 2018 Sep;73(3):166-171. doi: 10.1007/s11130-018-0677-y.
Garcia Lopez M, Baron JA, Omsland TK, Søgaard AJ, Meyer HE. Homocysteine-Lowering Treatment and the Risk of Fracture: Secondary Analysis of a Randomized Controlled Trial and an Updated Meta-Analysis. JBMR Plus. 2018 Mar 24;2(5):295-303. doi: 10.1002/jbm4.10045. eCollection 2018 Sep.
Gerrard A, Dawson C. Homocystinuria diagnosis and management: it is not all classical. J Clin Pathol. 2022 Sep 19:jclinpath-2021-208029. doi: 10.1136/jcp-2021-208029.
Gilsing AM, Crowe FL, Lloyd-Wright Z, Sanders TA, Appleby PN, Allen NE, Key TJ. Serum concentrations of vitamin B12 and folate in British male omnivores, vegetarians and vegans: results from a cross-sectional analysis of the EPIC-Oxford cohort study. Eur J Clin Nutr. 2010 Sep;64(9):933-9.
Gomollón F, Gargallo CJ, Muñoz JF, Vicente R, Lue A, Mir A, García-Alvarado M,Gracia M, García-López S. Oral Cyanocobalamin is Effective in the Treatment of Vitamin B12 Deficiency in Crohn's Disease. Nutrients. 2017 Mar 20;9(3). pii: E308. doi: 10.3390/nu9030308.
Grover IS, Bharti R, Kapahi R, Sodhi MK, Kapahi R. Correlations between serum vitamin B12 and folate levels among mother-infant dyads in Punjab state, North-West India. J Paediatr Child Health. 2022 Sep 13. doi: 10.1111/jpc.16207.
Guéant JL, Guéant-Rodriguez RM, Alpers DH. Vitamin B12 absorption and malabsorption. Vitam Horm. 2022;119:241-274. doi: 10.1016/bs.vh.2022.01.016.
Guéant JL, Guéant-Rodriguez RM, Alpers DH. Vitamin B12 absorption and malabsorption. Vitam Horm. 2022;119:241-274. doi: 10.1016/bs.vh.2022.01.016.
Guyton y Hall. Tratado de Fisiología Médica. Elsevier.
Halsted JA, Carroll J, Rubert S. Serum and tissue concentration of vitamin B12 in certain pathologic states. N Engl J Med. 1959;260:575-80.
Hanger HC, Sainsbury R, Gilchrist NL, Beard ME, Duncan JM. A community study of vitamin B12 and folate levels in the elderly. J Am Geriatr Soc. 1991;39:1155–1159.
Herbert V, Castle WB. Intrinsec factor. N Engl J Med 1964;270:118-26.
Herbert V. Staging vitamin B-12 (cobalamin) status in vegetarians. Am J Clin Nutr. 1994 May;59(5 Suppl):1213S-1222S. Review.
Herrmann W, Schorr H, Obeid R, Geisel J. Vitamin B-12 status, particularly holotranscobalamin II and methylmalonic acid concentrations, and hyperhomocysteinemia in vegetarians. Am J Clin Nutr. 2003 Jul;78(1):131-6.
Homocysteine Studies Collaboration. Homocysteine and risk of ischemic heart disease and stroke: a meta-analysis. JAMA. 2002;288:2015 - 2022.
Howard JM, Azen C, Jacobsen DW, Green R, Carmel R. Dietary intake of cobalamin in elderly people who have abnormal serum cobalamin, methylmalonic acid and homocysteine levels. Eur J Clin Nutr. 1998;52:582–587.
Huang HH, Cohen AA, Gaudreau P, Auray-Blais C, Allard D, Boutin M, Reid I, Turcot V, Presse N. Vitamin B-12 Intake from Dairy But Not Meat is Associated with Decreased Risk of Low Vitamin B-12 Status and Deficiency in Older Adults from Quebec, Canada. J Nutr. 2022 Jun 23:nxac143. doi: 10.1093/jn/nxac143.
Huđek Turković A, Matovinović M, Žuna K, Škara L, Kazazić S, Bačun-Družina V, Durgo K. Association of Vitamins D, B9 and B12 with Obesity-Related Diseases and Oral Microbiota Composition in Obese Women in Croatia. Food Technol Biotechnol. 2022 Jun;60(2):135-144. doi: 10.17113/ftb.60.02.22.7478.
Imerslund-Gräsbeck syndrome (selective vitamin B12 malabsorption with proteinuria) Orphanet Journal of Rare Diseases2006 Ralph Gräsbeck. Ingestas Dietéticas de Referencia para Población Española. FESNAD, 2010. Institute of Medicine (US) Standing Committee on the Scientific Evaluation of Dietary Reference Intakes and its Panel on Folate, Other B Vitamins, and Choline. Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington (DC): National Academies Press (US); 1998.
Interrelación entre vitamina B12 y ácido fólico. Dr. Bernardo Condado Arenas. Ishtulin AF, Korotkova NV, Matveeva IV, Minaev IV, Polyakova PM. Vitamin B12 kak diagnosticheskiĭ marker snizheniia reproduktivnoĭ funktsii u muzhchin [Vitamin B12 is a diagnostic marker of decreased men reproductive function]. Biomed Khim. 2022 Jun;68(3):228-231. Russian. doi: 10.18097/PBMC20226803228.
Jack Norris. veganhealth.org
Jaeger B, Corpeleijn W, Dijsselhof M, Goorden S, Haverkamp J, Langeveld M, Waterham H, Westerbeek E, Bosch AM. Mind the B2: Life-Threatening Neonatal Complications of a Strict Vegan Diet during Pregnancy. Neonatology. 2022 Sep 19:1-4. doi: 10.1159/000526334.
Kacharava T, Giorgadze E, Janjgava S, Lomtadze N, Iamze T. Correlation between Vitamin B12 Deficiency and Autoimmune Thyroid Diseases. Endocr Metab Immune Disord Drug Targets. 2022 Jun 27. doi: 10.2174/1871530322666220627145635.
Kalkan Ç, Karakaya F, Tüzün A, Gençtürk ZB, Soykan I. Factors related to low serum vitamin B12 levels in elderly patients with non-atrophic gastritis in contrast to patients with normal vitamin B12 levels. Geriatr Gerontol Int. 2016 Jun;16(6):686-92.
Karnaze DS, Carmel R. Neurologic and evoked potential abnormalities in subtle cobalamin deficiency states, including deficiency without anemia and with normal absorption of free cobalamin. Arch Neurol. 1990 Sep;47(9):1008-12.
Khattab R, Albannawi M, Alhajjmohammed D, Alkubaish Z, Althani R, Altheeb L, Ayoub H, Mutwalli H, Altuwajiry H, Al-Sheikh R, Purayidathil T, Abuzaid O. Metformin-Induced Vitamin B12 Deficiency among Type 2 Diabetes Mellitus' Patients: A Systematic Review. Curr Diabetes Rev. 2022 Apr 18. doi: 10.2174/1573399818666220418080959.
Kim HI, Hyung WJ, Song KJ, Choi SH, Kim CB, Noh SH. Oral vitamin B12 replacement: an effective treatment for vitamin B12 deficiency after total gastrectomy in gastric cancer patients. Ann Surg Oncol. 2011 Dec;18(13):3711-7.
Klerk M, Verhoef P, Clarke R, Blom HJ, Kok FJ, Schouten EG. MTHFR C77CT polymorphism and risk of coronary heart disease: a meta-analysis. JAMA 2002;288:2023-31.
Kolhouse JF, Kondo H, Allen NC, Podell E, Allen RH. Cobalamin analogues are present in human plasma and can mask cobalamin deficiency because current radioisotope dilution assays are not specific for true cobalamin. N Engl J Med. 1978 Oct 12;299(15):785-92.
Kostick N, Chen E, Eckert T, Sirotkin I, Baldinger E, Frontera A. Clinical Presentation of Subacute Combined Degeneration in a Patient With Chronic B12 Deficiency. Fed Pract. 2022 Mar;39(3):142-146. doi: 10.12788/fp.0228. Epub 2022 Mar 14.
Koyama K, Yoshida A, Takeda A, Morozumi K, Fujinami T, Tanaka N. Abnormal cyanide metabolism in uraemic patients. Nephrol Dial Transplant. 1997 Aug;12(8):1622-8.
Koyyalamudi SR, Jeong SC, Cho KY, Pang G. Vitamin B12 is the active corrinoid produced in cultivated white button mushrooms (Agaricus bisporus). J Agric Food Chem. 2009 Jul 22;57(14):6327-33.
Kuzminski AM, Del Giacco EJ, Allen RH, Stabler SP, Lindenbaum J. Effective treatment of cobalamin deficiency with oral cobalamin. Blood. 1998 Aug 15;92(4):1191-8.
L.Kathleen Mahan y Janice L. Raymond. Krause Dietoterapia. Lamers Y. Vitamin B-12 Requirements in Older Adults-Increasing Evidence Substantiates the Need To Re-Evaluate Recommended Amounts and Dietary Sources. J Nutr. 2022 Sep 22:nxac179. doi: 10.1093/jn/nxac179.
Lane LA, Rojas-Fernandez C. Treatment of vitamin b(12)-deficiency anemia: oral versus parenteral therapy. Ann Pharmacother. 2002 Jul-Aug;36(7-8):1268-72. Review.
Lanzkowski P. Anemias megaloblásticas y otras anemias nutricionales. En: Hematología pediátrica. 3a ed. La Habana, 1983:195-237. (Edición Revolucionaria).
Lawhorne L, Ringdahl D. Cyanocobalamin injections for patients without documented deficiency: reasons for administration and patient responses to proposed discontinuation. JAMA. 1989;261:1920–1923.
Lawrence AC, Bevington JM, Young M. Storage of blood and the mean corpuscular volume. J Clin Pathol. 1975 May;28(5):345-9.
Lee YK, Kim HS, Kang HJ. Holotranscobalamin as an indicator of vitamin B12 deficiency in gastrectomized patients. Ann Clin Lab Sci. 2009 Fall;39(4):361-6.
Lerman TT, Cohen E, Sochat T, Goldberg E, Goldberg I, Krause I. Proton pump inhibitor use and its effect on vitamin B12 and homocysteine levels among men and women: A large cross-sectional study. Am J Med Sci. 2022 Jul 24:S0002-9629(22)00313-5. doi: 10.1016/j.amjms.2022.07.006.
Lesbia Meertens R, Liseti Solano R. Vitamina B12, ácido fólico y función mental en adultos mayores. Invest. Clin. Scielo Chile. [en línea] Marzo de 2005 [fecha de acceso 4 de Octubre de 2017]; 46 (1).
Lic. Mariela Forrellat Barrios, Lic. Irma Gómis Hernández y Dra. Hortensia Gautier du Défaix Gómez, Vitamina B12, metabolismo y aspectos clínicos de su deficiencia. Rev Cubana Hematol Inmunol Hemoter 1999;15(3):159-74.
Linnell JC, Matthews DM. Cobalamin metabolism and its clinical aspects. Clin Sci (Lond). 1984 Feb;66(2):113-21.
Loehrer FM, Schwab R, Angst CP, Haefeli WE, Fowler B. Influence of oral S-adenosylmethionine on plasma 5-methyltetrahydrofolate, S-adenosylhomocysteine, homocysteine and methionine in healthy humans. J Pharmacol Exp Ther. 1997 Aug;282(2):845-50.
Martens JH, Barg H, Warren MJ, Jahn D. Microbial production of vitamin B12. Appl Microbiol Biotechnol. 2002;58:275–285.
Martínez Sánchez P. Anemias por alteración de la síntesis de ADN. Anemias megaloblásticas. Medicine. Doyma. [en línea] Septiembre de 2001.
Martín-Rivada Á, Cambra Conejero A, Martín-Hernández E, Moráis López A, Bélanger-Quintana A, Cañedo Villarroya E, Quijada-Fraile P, Bellusci M, Chumillas Calzada S, Bergua Martínez A, Stanescu S, Martínez-Pardo Casanova M, Ruíz-Sala P, Ugarte M, Pérez González B, Pedrón-Giner C. Newborn screening for propionic, methylmalonic acidemia and vitamin B12 deficiency. Analysis of 588,793 newborns. J Pediatr Endocrinol Metab. 2022 Sep 19. doi: 10.1515/jpem-2022-0340.
Mascarenhas R, Gouda H, Ruetz M, Banerjee R. Human B12-dependent enzymes: Methionine synthase and Methylmalonyl-CoA mutase. Methods Enzymol. 2022;668:309-326. doi: 10.1016/bs.mie.2021.12.012. Epub 2022 Jan 30.
McMahon JA, Green TJ, Skeaff CM, Knight RG, Mann JI, Williams SM. A controlled trial of homocysteine lowering and cognitive performance. N Engl J Med. 2006 Jun 29;354(26):2764-72.
Merchant RE, Phillips TW, Udani J. Nutritional Supplementation with Chlorella pyrenoidosa Lowers Serum Methylmalonic Acid in Vegans and Vegetarians with a Suspected Vitamin B₁₂ Deficiency. J Med Food. 2015 Dec;18(12):1357-62.
Mizrahi EH, Jacobsen DW, Friedland RP. Plasma homocysteine: a new risk factor for Alzheimer's disease? Isr Med Assoc J. 2002;4:187 - 190.
Moghadasian MH, McManus BM, Frohlich JJ. Homocyst(e)ine and coronary artery disease. Arch Intern Med. 1997;157:2299 - 2308.
Mok KC, Hallberg ZF, Taga ME. Purification and detection of vitamin B12 analogs. Methods Enzymol. 2022;668:61-85. doi: 10.1016/bs.mie.2021.11.023. Epub 2021 Dec 30.
Morado, M., & Paz, R. de. (2011). Anemia megaloblástica y gastritis atrófica. Revista Española de Enfermedades Digestivas, 103(6), 332.
Morales-Gutierrez J, Díaz-Cortés S, Montoya-Giraldo MA, Zuluaga AF. Toxicity induced by multiple high doses of vitamin B(12) during pernicious anemia treatment: a case report. Clin Toxicol (Phila). 2019 Apr 24:1-3. doi: 10.1080/15563650.2019.1606432.
Mounsey A, Brendle DC, Flowers K. Oral vs. Intramuscular Vitamin B12 for Treating Vitamin B12 Deficiency. Am Fam Physician. 2022 Jun;105(6):663-664.
N RS, Sharma R, Madhulata, Sharma R. Pancytopenia: Etiology and it's Variables. J Assoc Physicians India. 2022 Apr;70(4):11-12.
Nexo E, Hoffmann-Lücke E. Holotranscobalamin, a marker of vitamin B-12 status: analytical aspects and clinical utility. Am J Clin Nutr. 2011 Jul;94(1):359S-365S. doi: 10.3945/ajcn.111.013458. Epub 2011 May 18. Review.
Niiyama S, Mukai H. Reversible cutaneous hyperpigmentation and nails with white hair due to vitamin B12 deficiency. Eur J Dermatol.2007 Nov-Dec;17(6):551-2. Epub 2007 Oct 19.
Nyholm E., Turpin P., Swain D., Cunningham B., Daly S., Nightingale P., Fegan C. Oral vitamin B12 can change our practice. Postgrad. Med. J. 2003;79:218–220. doi: 10.1136/pmj.79.930.218.
Oki R,et al. Japan Early-Stage Trial of Ultrahigh-Dose Methylcobalamin for ALS (JETALS) Collaborators. Efficacy and Safety of Ultrahigh-Dose Methylcobalamin in Early-Stage Amyotrophic Lateral Sclerosis: A Randomized Clinical Trial. JAMA Neurol. 2022 Jun 1;79(6):575-583. doi: 10.1001/jamaneurol.2022.0901.
O'Leary F, Samman S. Vitamin B12 in health and disease. Nutrients. 2010 Mar;2(3):299-316. doi: 10.3390/nu2030299. Epub 2010 Mar 5. Review.
Pawlak R, Lester SE, Babatunde T. The prevalence of cobalamin deficiency among vegetarians assessed by serum vitamin B12: a review of literature. Eur J Clin Nutr. 2014 May;68(5):541-8. doi: 10.1038/ejcn.2014.46. Epub 2014 Mar 26. Review.
Pecikoza U, Tomić M, Nastić K, Micov A, Stepanović-Petrović R. Synergism between metformin and analgesics/vitamin B12 in a model of painful diabetic neuropathy. Biomed Pharmacother. 2022 Sep;153:113441. doi: 10.1016/j.biopha.2022.113441.
Pfnür IAH. Vitamin B12 Deficiency as the Cause. Dtsch Arztebl Int. 2022 Mar 25;119(12):216. doi: 10.3238/arztebl.m2022.0053.
Praveen G, Sivaprasad M, Reddy GB. Telomere length and vitamin B12. Vitam Horm. 2022;119:299-324. doi: 10.1016/bs.vh.2022.01.014.
Praveen G, Sivaprasad M, Reddy GB. Telomere length and vitamin B12. Vitam Horm. 2022;119:299-324. doi: 10.1016/bs.vh.2022.01.014.
R Muhammad, MD, P Fernhoff, MD, Dept of Pediatrics, Emory Univ, Atlanta, Georgia. S Rasmussen, MD, Div of Birth Defects and Developmental Disabilities; B Bowman, PhD, Div of Diabetes Translation; K Scanlon, PhD, L Grummer-Strawn, PhD, L Kettel Khan, PhD, Div of Nutrition and Physical Activity, National Center for Chronic Disease Prevention and Health Promotion; M Jefferds, PhD, EIS Officer, CDC.
Rasmussen K, Moelby L, Jensen MK. Studies on methylmalonic acid in humans. II. Relationship between concentrations in serum and urinary excretion, and the correlation between serum cobalamin and accumulation of methylmalonic acid. Clin Chem. 1989 Dec;35(12):2277-80.
Refsum H, Yajnik CS, Gadkari M, Schneede J, Vollset SE, Orning L, Guttormsen AB, Joglekar A, Sayyad MG, Ulvik A, Ueland PM. Hyperhomocysteinemia and elevated methylmalonic acid indicate a high prevalence of cobalamin deficiency in Asian Indians. Am J Clin Nutr. 2001 Aug;74(2):233-41.
Reischl-Hajiabadi AT, Garbade SF, Feyh P, Weiss KH, Mütze U, Kölker S, Hoffmann GF, Gramer G. Maternal Vitamin B12 Deficiency Detected by Newborn Screening-Evaluation of Causes and Characteristics. Nutrients. 2022 Sep 13;14(18):3767. doi: 10.3390/nu14183767.
Rhode BM, Tamim H, Gilfix BM, Sampalis JS, Nohr C, MacLean LD. Treatment of vitamin B12 deficiency after gastric surgery for severe obesity. Obes Surg. 1995;5:154–158.
Rizzo G, Laganà AS, Rapisarda AM, La Ferrera GM, Buscema M, Rossetti P, Nigro A, Muscia V, Valenti G, Sapia F, Sarpietro G, Zigarelli M, Vitale SG. Vitamin B12 among Vegetarians: Status, Assessment and Supplementation. Nutrients. 2016 Nov 29;8(12).
Rodriguez NM, Shackelford K. Pernicious Anemia. 2022 Jul 4. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan
Rodriguez-Carnero G, Lorenzo PM, Canton-Blanco A, Mendizabal L, Arregi M, Zulueta M, Simon L, Macia-Cortiñas M, Casanueva FF, Crujeiras AB. Genetic Variants in Folate and Cobalamin Metabolism-Related Genes in Pregnant Women of a Homogeneous Spanish Population: The Need for Revisiting the Current Vitamin Supplementation Strategies. Nutrients. 2022 Jun 29;14(13):2702. doi: 10.3390/nu14132702.
Sadagopan N. Severe Hemolytic Anemia due to Vitamin B12 Deficiency in Six Months. Hematol Rep. 2022 Jun 22;14(3):210-212. doi: 10.3390/hematolrep14030028.
Samson ME, Yeung LF, Rose CE, Qi YP, Taylor CA, Crider KS. Vitamin B-12 malabsorption and renal function are critical considerations in studies of folate and vitamin B-12 interactions in cognitive performance: NHANES 2011-2014. Am J Clin Nutr. 2022 Jul 6;116(1):74-85. doi: 10.1093/ajcn/nqac065.
Sarode R, Garewal G, Marwaha N, Marwaha RK, Varma S, Ghosh K, Mohanty D, Das KC. Pancytopenia in nutritional megaloblastic anaemia. A study from north-west India. Trop Geogr Med. 1989 Oct;41(4):331-6.
Sechi LA, De Carli S, Catena C, Zingaro L, Bartoli E. Benign familial macrocytosis. Clin Lab Haematol. 1996 Mar;18(1):41-3.
Shankar PR. VigiAccess: promoting public access to VigiBase.Indian J Pharmacol. 2016;48:606–607. y vigiaccess.org/
Sharabi A, Cohen E, Sulkes J, Garty M. Replacement therapy for vitamin B12 deficiency: comparison between the sublingual and oral route. Br J Clin Pharmacol. 2003 Dec;56(6):635-8.
Shen Y, Huang L, Zou Y, Su D, He M, Fang Y, Zhao D, Wang W, Zhang R. Intake of Vitamin B12 and Folate and Biomarkers of Nutrient Status of Women within Two Years Postpartum. Nutrients. 2022 Sep 19;14(18):3869. doi: 10.3390/nu14183869. P
Shivkar RR, Gawade GC, Padwal MK, Diwan AG, Mahajan SA, Kadam CY. Association of MTHFR C677T (rs1801133) and A1298C (rs1801131) Polymorphisms with Serum Homocysteine, Folate and Vitamin B12 in Patients with Young Coronary Artery Disease. Indian J Clin Biochem. 2022 Apr;37(2):224-231. doi: 10.1007/s12291-021-00982-1.
Shorb, M. S. (1947). Unidentified Essential Growth Factors for Lactobacillus-Lactis Found in Refined Liver Extracts and in Certain Natural Materials. Journal of Bacteriology 53, 669-669.
Shorb, M. S. (1948). Activity of Vitamin-B12 for the Growth of Lactobacillus-Lactis. Science 107, 397-398.
Silverstein WK, Cheung MC, Lin Y. Vitamin B12 deficiency. CMAJ. 2022 Jun 20;194(24):E843. doi: 10.1503/cmaj.220306.
Silverstein WK, Cheung MC, Lin Y. Vitamin B12 deficiency. CMAJ. 2022 Jun 20;194(24):E843. doi: 10.1503/cmaj.220306.
Simeone G, Bergamini M, Verga MC, Cuomo B, D'Antonio G, Iacono ID, Mauro DD, Mauro FD, Mauro GD, Leonardi L, Miniello VL, Palma F, Scotese I, Tezza G, Vania A, Caroli M. Do Vegetarian Diets Provide Adequate Nutrient Intake during Complementary Feeding? A Systematic Review. Nutrients. 2022 Aug 31;14(17):3591. doi: 10.3390/nu14173591.
Singh J, Dinkar A, Gupta P, Atam V. Vitamin B12 deficiency in northern India tertiary care: Prevalence, risk factors and clinical characteristics. J Family Med Prim Care. 2022 Jun;11(6):2381-2388. doi: 10.4103/jfmpc.jfmpc_650_21.
Stabler SP, Allen RH. Vitamin B12 deficiency as a worldwide problem. Annu Rev Nutr. 2004;24:299-326. Review.
Susan E. Mulroney. Adam K. Myers. Netter Fundamentos de Fisiología. 2da edición. Elsevier.
Susanti D, Ruslan FS, Shukor MI, Nor NM, Aminudin NI, Taher M, Khotib J. Optimisation of Vitamin B12 Extraction from Green Edible Seaweed (Ulva lactuca) by Applying the Central Composite Design. Molecules. 2022 Jul 12;27(14):4459. doi: 10.3390/molecules27144459.
Talari HR, Molaqanbari MR, Mokfi M, Taghizadeh M, Bahmani F, Tabatabaei SMH, Sharifi N. The effects of vitamin B12 supplementation on metabolic profile of patients with non-alcoholic fatty liver disease: a randomized controlled trial. Sci Rep. 2022 Aug 18;12(1):14047. doi: 10.1038/s41598-022-18195-8.
Tandon R, Thacker J, Pandya U, Patel M, Tandon K. Parenteral vs Oral Vitamin B12 in Children With Nutritional Macrocytic Anemia: A Randomized Controlled Trial. Indian Pediatr. 2022 Sep 15;59(9):683-687.
Taneja S, Chowdhury R, Kvestad I, Bhandari N, Strand TA. Vitamin B12 and/or folic acid supplementation on linear growth; a 6 years follow-up study of a randomised controlled trial in early childhood in North India. Br J Nutr. 2022 Jul 25:1-22. doi: 10.1017/S0007114522002343.
Ting RZ, Szeto CC, Chan MH, Ma KK and Chow KM. Risk factors of vitamin B(12) deficiency in patients receiving metformin. Archives of internal medicine. 2006 Oct 9; 166 (18) :1975-9.
Tucker KL, Rich S, Rosenberg I, Jacques P, Dallal G, Wilson PW, Selhub J. Plasma vitamin B-12 concentrations relate to intake source in the Framingham Offspring study. Am J Clin Nutr. 2000 Feb;71(2):514-22.
Ueno A, Hamano T, Enomoto S, Shirafuji N, Nagata M, Kimura H, Ikawa M, Yamamura O, Yamanaka D, Ito T, Kimura Y, Kuriyama M, Nakamoto Y. Influences of Vitamin B12 Supplementation on Cognition and Homocysteine in Patients with Vitamin B12 Deficiency and Cognitive Impairment. Nutrients. 2022 Apr 2;14(7):1494. doi: 10.3390/nu14071494.
Ueno A, Hamano T, Enomoto S, Shirafuji N, Nagata M, Kimura H, Ikawa M, Yamamura O, Yamanaka D, Ito T, Kimura Y, Kuriyama M, Nakamoto Y. Influences of Vitamin B12 Supplementation on Cognition and Homocysteine in Patients with Vitamin B12 Deficiency and Cognitive Impairment. Nutrients. 2022 Apr 2;14(7):1494. doi: 10.3390/nu14071494.
Üstün Özek S. A study on the correlation between pain frequency and severity and vitamin B12 levels in episodic and chronic migraine. Arq Neuropsiquiatr. 2022 Jun;80(6):586-592. doi: 10.1590/0004-282X-ANP-2021-0192.
Vademecum. Prospecto Optovite. vademecum.es
van Loon SL, Wilbik AM, Kaymak U, van den Heuvel ER, Scharnhorst V, Boer AK. Improved testing for vitamin B(12) deficiency: correcting MMA for eGFR reduces the number of patients classified as vitamin B(12) deficient. Ann Clin Biochem. 2018.
Vidal-Alaball J, Butler CC, Cannings-John R, Goringe A, Hood K, McCaddon A,McDowell I, Papaioannou A. Oral vitamin B12 versus intramuscular vitamin B12 for vitamin B12 deficiency. Cochrane Database Syst Rev. 2005 Jul 20;(3):CD004655. Review.
Vitamin Supplementation as Possible Prophylactic Treatment against Migraine with Aura and Menstrual Migraine Munvar Miya Shaik and Siew Hua Gan. Biomed Res Int. 2015; 2015: 469529.
Wang C, Zhang Y, Shu J, Gu C, Yu Y, Liu W. Association Between Methylmalonic Acid and Cognition: A Systematic Review and Meta-Analysis. Front Pediatr. 2022 Jun 29;10:901956. doi: 10.3389/fped.2022.901956.
Wang C, Zhang Y, Shu J, Gu C, Yu Y, Liu W. Association Between Methylmalonic Acid and Cognition: A Systematic Review and Meta-Analysis. Front Pediatr. 2022 Jun 29;10:901956. doi: 10.3389/fped.2022.901956.
Watanabe F, Schwarz J, Takenaka S, Miyamoto E, Ohishi N, Nelle E, Hochstrasser R, Yabuta Y. Characterization of vitamin B₁₂compounds in the wild edible mushrooms black trumpet (Craterellus cornucopioides) and golden chanterelle (Cantharellus cibarius).
Watanabe F, Takenaka S, Kittaka-Katsura H, Ebara S, Miyamoto E. Characterization and bioavailability of vitamin B12-compounds from edible algae. J Nutr Sci Vitaminol (Tokyo). 2002 Oct;48(5):325-31. Review.
Wei J, Wei Y, Huang M, Wang P, Jia S. Is metformin a possible treatment for diabetic neuropathy? J Diabetes. 2022 Sep 18. doi: 10.1111/1753-0407.13310
White ND. Vitamin B12 and Plant-Predominant Diets. Am J Lifestyle Med. 2022 May 4;16(3):295-297. doi: 10.1177/15598276221076102.
Wong S, Ahmad N, Rossetti AL. Vomiting as a Presenting Symptom of Infantile Vitamin B12 Deficiency. Cureus. 2022 May 19;14(5):e25134. doi: 10.7759/cureus.25134.
Wu HHL, Wang AY. Vitamin B12 and chronic kidney disease. Vitam Horm. 2022;119:325-353. doi: 10.1016/bs.vh.2022.01.011.
Wu HHL, Wang AY. Vitamin B12 and chronic kidney disease. Vitam Horm. 2022;119:325-353. doi: 10.1016/bs.vh.2022.01.011.
Wulffelé MG, Kooy A, Lehert P, Bets D, Ogterop JC, Borger van der Burg B, Donker AJ, Steouwer CD. Effects of short-term treatment with metformin on serum concentrations of homocysteine, folate and vitamin B12 in type 2 diabetes mellitus: a randomized, placebo-controlled trial. J Intern Med. 2003 Nov;254(5):455-63.
Xu B, Zhang L, Chen Q, Wang Y, Peng Y, Tang H. Case Report: A Case of Late-Onset Combined Methylmalonic Acidemia and Hyperhomocysteinemia Induced by a Vegetarian Diet. Front Pediatr. 2022 Jul 12;10:896177. doi: 10.3389/fped.2022.896177.
Yan S, Liu H, Yu Y, Han N, Du W. Changes of Serum Homocysteine and Vitamin B12, but Not Folate Are Correlated With Obsessive-Compulsive Disorder: A Systematic Review and Meta-Analysis of Case-Control Studies. Front Psychiatry. 2022 May 9;13:754165. doi: 10.3389/fpsyt.2022.754165.
Yu YM, So SKC, Khallouq BB. The effect of metformin on vitamin B12 levels in pediatric patients. Ann Pediatr Endocrinol Metab. 2022 May 16. doi: 10.6065/apem.2142210.105.
Yuan X, Han X, Zhou W, Long W, Wang H, Yu B, Zhang B. Association of folate and vitamin B12 imbalance with adverse pregnancy outcomes among 11,549 pregnant women: An observational cohort study. Front Nutr. 2022 Jul 25;9:947118. doi: 10.3389/fnut.2022.947118.
Zhang B, Dong H, Xu Y, Xu D, Sun H, Han L. Associations of dietary folate, vitamin B6 and B12 intake with cardiovascular outcomes in 115664 participants: a large UK population-based cohort. Eur J Clin Nutr. 2022 Sep 13. doi: 10.1038/s41430-022-01206-2.
Zibold J, von Livonius B, Kolarova H, Rudolph G, Priglinger CS, Klopstock T, Catarino CB. Vitamin B12 in Leber hereditary optic neuropathy mutation carriers: a prospective cohort study. Orphanet J Rare Dis. 2022 Aug 9;17(1):310. doi: 10.1186/s13023-022-02453-z.
Zou R, Dai Y, Wang D, Zhang X. Association between MTHFR polymorphism and seizure control in epileptic patients with hyperhomocysteinaemia. Epileptic Disord. 2022 Oct 1;24(5):1-9. English. doi: 10.1684/epd.2022.1470.
Citar como: Robledo V. Todo sobre la vitamina B12. Bioquímica, diagnóstico, clínica y suplementación. ICNS. Accesible en https://www.icns.es/articulo_vitamina-B12
Copyright© ICNS Instituto





















