Nutrición
Intolerancia a la lactosa: causas, síntomas, diagnóstico y tratamiento.

La lactosa es un azúcar presente en cantidades variables en diferentes alimentos; especialmente en leche y derivados. Los lácteos son una fuente interesante de nutrientes para los mamíferos, sobre todo en las primeras etapas. Sin embargo, no son imprescindibles de por vida. Un alto porcentaje de la población humana presenta mala digestión y/o absorción de lactosa por deficiencia de la enzima lactasa-floricina hidrolasa (LHP), mientras otros la metabolizan bien. Por sí mismas, ambas son variaciones fisiológicas del metabolismo humano. Lo patológico viene cuando coincide el consumo de lactosa seguido de esa mala digestión y/o absorción más sintomatología que afecte al bienestar digestivo y extra-digestivo. A continuación se detalla qué es la intolerancia a la lactosa, siguiendo los pasos que propone Thomas Sydenham para el estudio de una patología.
Definición de intolerancia a la lactosa
La lactosa es el azúcar principal de la leche humana; es un disacárido formado por glucosa y galactosa. La intolerancia a la lactosa es un defecto en la digestión y/o absorción de lactosa por ausencia y/o fallo funcional de LHP -deficiencia de LHP- sumado a sintomatología que comprometa el estado de bienestar, tras su ingesta.
Intolerancia a la lactosa = ingesta de lactosa + mala digestión y/o absorción + sintomatología problemática.
Causas de la intolerancia a la lactosa
La intolerancia a la lactosa puede ser congénita o adquirida. En la primera etapa de vida de los mamíferos, la leche constituye el alimento por excelencia y así de alta suele ser la actividad de la LHP. Algunos científicos defienden que la exposición a lactosa tiene un cierto grado de modulación en la expresión de una mala absorción y/o digestión, ya que existen procesos fisiológicos de “adaptación colónica” reversibles. Sin embargo, una mayor exposición no es garantía de mejor metabolismo. Se recomienda una exposición gradual. Generalmente, se habla de deficiencia de LHP cuando su actividad es menor al 50% o en ausencia de su expresión.
En el Homo sapiens sapiens, entre los 2 y los 10 años de edad, la LHP va dejando de ser tan activa. Sin embargo, varios factores genéticos, epigenéticos y ambientales han modulado nuestra respuesta digestiva a los lácteos. En algunos nativos finlandeses, se ha observado una reducción de actividad enzimática tardía: entre los 10 a los 20 años de vida. A esos individuos se les atribuye el rasgo de persistencia de la lactasa y su trasfondo genético fue confirmado por el equipo de Enattah en 2002. Las causas conocidas de intolerancia a la lactosa se clasifican en:
Fisiología y fisiopatología
En el yeyuno medio suele expresarse más LHP, pero con una distribución heterogénea. La enzima LHP es capaz de separar la lactosa en sus monosacáridos y así facilita su absorción. Tras la digestión de lactosa, glucosa y galactosa pueden atravesar la membrana de los enterocitos mediante transportadores del tipo SGLUT, en compañía de sodio y agua. También pueden hacerlo por difusión facilitada mediante GLUTs y algún otro mecanismo. Posteriormente, llegan al hígado y siguen vías donde pueden ser usadas como fuente energética.
En el momento en que no es digerida por las células propias, la lactosa queda disponible para que las bacterias colónicas la transformen en ácidos grasos de cadena corta, CO2, H2 y otros metabolitos. Con bacterias del tipo Bifidobacterium y Lactobacillus no se producen los gases mencionados. De hecho, tener el SNP rs4988235 se ha asociado a poseer mayor cantidad de bifidobacterias. Además, durante la mala absorción/digestión se acumulan sustancias como acetaldehído, etanol, acetona y péptidos con toxicidad potencial. Cuando no se reabsorben estos desechos y se acumula la lactosa no hidrolizada, suele aumentar la osmolaridad y el peristaltismo. Es entonces cuando pueden aparecer síntomas y signos que ya describía Hipócrates hace unos 2400 años.
Clínica y síntomas
Para los síntomas y signos, se puede hablar de dos tiempos:
Se estima que los síntomas aparecen entre los 30 minutos y las 3 horas después de ingerir la lactosa; tener en cuenta que el vaciado gástrico en la mujer suele ser más lento que en el hombre. Además, la hipersensibilidad a la distensión y expectativas negativas ante los lácteos pueden tener efecto nocebo.
Para comunicación terapeuta-paciente puede ser práctico emplear escalas como la de Bristol, respecto a diferenciar diarrea de estreñimiento. Así como otras escalas con puntuaciones del 0 al 10, respecto al dolor y la distensión abdominal.
Diagnóstico
Parece más adecuado combinar tanto test de aliento como el de tolerancia a la lactosa, pero existen diversas pruebas asociadas a intolerancia a la lactosa.
La revisión de Misselwitz y colaboradores contiene un resumen de ventajas y desventajas de las pruebas diagnósticas más un diagrama de toma de decisiones. También, en la Asociación de intolerantes a la lactosa España (Adilac) se pueden consultar ejemplos de analíticas. Aunque aquellas herramientas no deberían sustituir al propio criterio del profesional sanitario.
Para un diagnóstico final es importante tanto la prueba positiva adecuada como la suma de síntomas clínicos de intolerancia a la lactosa. Dado que es frecuente los falsos positivos o negativos. Las pruebas actuales no cuentan con un 100% de especificidad y sensibilidad. Aunque circulan un estudio que valoró las pruebas usando el test genético para caucásicos como referencia. En ese estudio el test de gaxilosa obtuvo mejores puntuaciones: precisión de 0,93. Habría que contrastarlo.
Tratamiento
A continuación se habla de las estrategias y más adelante se hacen algunas descripciones nutricionales relevantes para el manejo de la intolerancia a la lactosa. El trabajo con adultos e infantes es distinto. En bebés, la lactancia materna se prioriza incluso ante diarrea aguda o prolongada, ya que la leche aporta mucho más que solo lactosa. Sin embargo, en algunos casos se prescribe el uso de leches de fórmula como en la alactasia congénita o en casos de malnutrición severa por problemas digestivos. En ambos grupos de edad pueden ser útiles los ensayos de tolerancia.
Los objetivos del tratamiento son:
Las estrategias se resumen en:
1) Uso de dietas reducidas o con exclusión de lácteos:
2) Uso de suplementos:
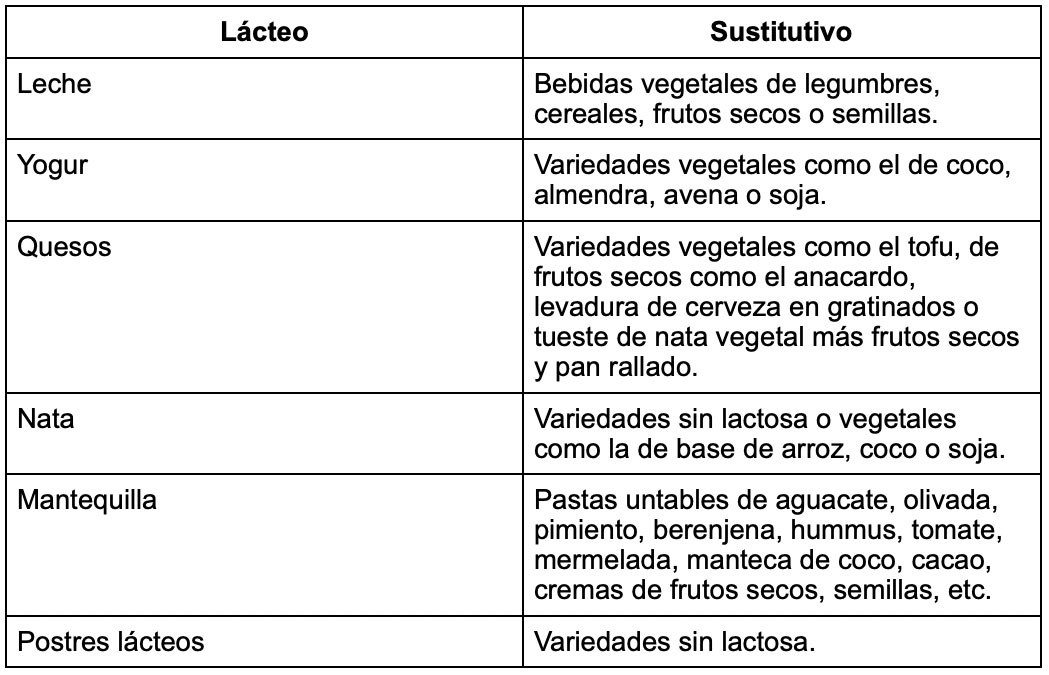
3) Uso de sustitutivos gastronómicos:
Existen diferentes preparaciones culinarias que funcionan como alternativa gastronómica a la hora de sustituir lácteos. Con el asesorado hay que valorar el coste-beneficio de este cambio. Estos preparados pueden desplazar la ingesta de otros alimentos con mayor densidad nutricional. Sin embargo, los humanos somos seres con posibilidad de refuerzos a varios niveles. En la elección de alimentos influyen tanto determinantes biológicos como económicos, físicos o psicológicos que pueden usarse para favorecer la adherencia a una pauta de alimentación.
4) Atención a otros pilares de la salud:
Otros factores como el sueño, el ejercicio físico de fuerza o la salud mental son relevantes. Respecto a los síntomas extra-digestivos, puede ser interesante el trabajo interdisciplinar, que no multidisciplinar. Por ejemplo: un acompañamiento conjunto entre psicología y nutrición. Muchas personas llevan años lidiando con percepción de digestiones molestas y acaban imbuidas en un ciclo de interconsultas a sanitarios y/o autodiagnosticándose. Aquello empobrece la calidad de vida. La coexistencia de otras dificultades digestivas o de pérdida de peso debe evaluarse y diagnosticarse adecuadamente. La existencia de sintomatología restrictiva y psicológica debe hacernos sospechar sobre posibles trastornos alimentarios, bidireccionalmente relacionados con sintomatología digestiva, lo cual puede superar las competencias de un abordaje exclusivamente nutricional. Detalles como estos se abordan en el Curso de Especialización en Anorexia Nerviosa, Bulimia y Trastorno por Atracón de ICNS.
Alimentos con lactosa
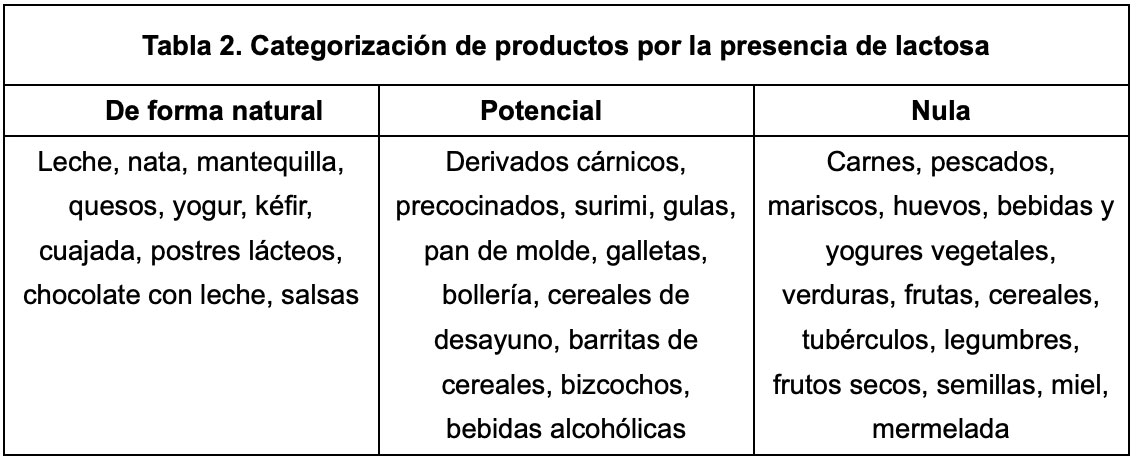
Se debe saber que los lácteos son un alérgeno potencial. Por ello, el Reglamento (UE) Nº 1169/2011 recogen que deben aparecer resaltados en el listado de ingredientes. Se debe prestar atención a palabras como: lactosa, monohidrato de lactosa, suero o suero de leche o suero lácteo y sólidos lácteos. Es muy probable que no sepamos la cantidad de lactosa que aportan (ver Tabla 3). Para una orientación, se debe contrastar ingredientes con cantidades de hidratos de carbono de la tabla de composición o directamente consultar al fabricante. Las alegaciones como “sin lactosa”, “libre de lactosa” o “deslactosado” pueden resultar confusas y no tienen una normativa estandarizada, excepto en fórmulas infantiles: su contenido en lactosa debe ser de hasta 10 mg de lactosa por cada 100 kcal. En España los productos con 0% de lactosa pueden contener <0.01% de la misma.
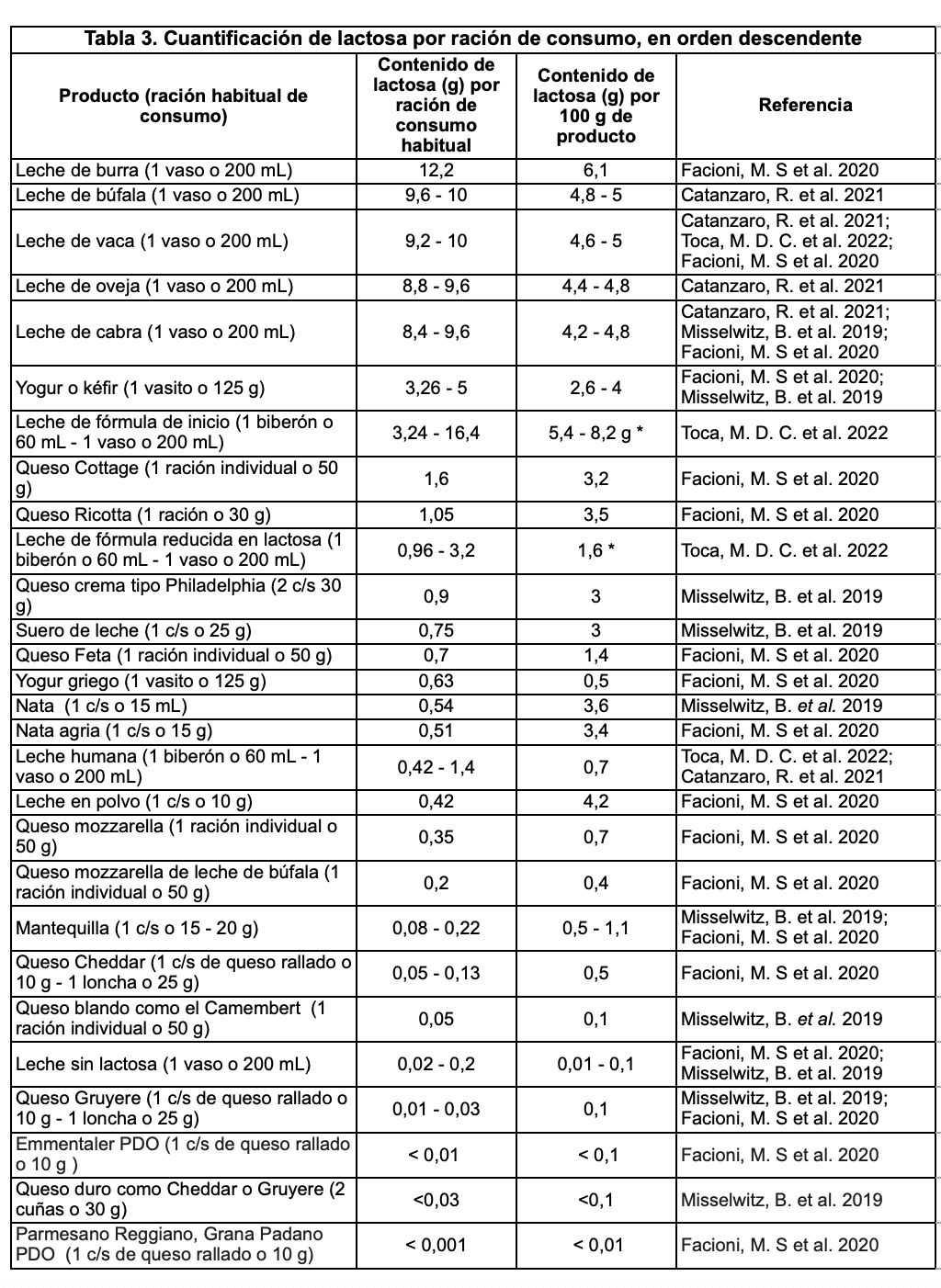
*La abreviatura c/s hace referencia a cucharada sopera. Según el Codex Alimentarius, las leches de fórmula pueden contener hasta un 30% de los azúcares en forma de maltodextrinas, con lo que se resta lactosa.
¿Qué cantidad de lactosa es adecuada?
No hay una sola respuesta. Una revisión habla de tolerancias de 5 g por toma. Se supone que, por ello, clasifican a los alimentos con estrategias de simplificación como un semáforo. Un ejemplo está en la Tabla 4. Por otro lado, un metanálisis concluye que los adultos intolerantes a la lactosa suelen aceptar dosis de 12 g de lactosa en una toma y hasta 25 g al día.

¿Cómo implementar un ensayo de tolerancia?
Se suele empezar por dietas libres de lactosa. A largo plazo, se adapta al rango de tolerancia. Se puede pactar con el paciente el llevar un registro incluyendo: fecha, producto ingerido, cantidad, síntomas, tiempo tras la ingesta y conclusiones. Es interesante fraccionar la ingesta de lactosa y acompañarla de otros alimentos con presencia nula de la misma. Aunque debemos valorar la posibilidad de contaminación cruzada en intolerantes extremos. De cada producto puede modificar las raciones en ¼, ½ o 1 dentro de escala baja del semáforo e ir ascendiendo. Es un trabajo de prueba y error. Puede hablarse de un entrenamiento digestivo. Los quesos curados y los yogures enteros naturales suelen tener buena tolerancia.
Por si hay interacciones, se puede tener en cuenta que otros monosacáridos como la fructosa usan vías de entrada al enterocito compartidas. Aunque, la fructosa además cuente con su vía exclusiva de transporte: los GLUT5. También que la lactosa puede estar presente en fármacos, como excipiente.
Calidad de los lácteos
Los lácteos son una fuente de energía, ácidos grasos, proteínas de alto valor biológico, calcio, fósforo, vitamina D, B12 y otros. A nivel de impacto metabólico, es preferible seleccionar lácteos en sus versiones más naturales, enteros y valorar su digestibilidad: queso curado, yogur natural, kéfir, leche entera materna, de cabra y oveja. Los productos enteros aumentan el efecto saciante gracias a las grasas.
Por estudios pre-clínicos, se considera que el efecto acidificante de la lactosa en el intestino mejoran la absorción de otros minerales como magnesio y zinc, pero faltaría confirmarlo en humanos. A la lactosa también se le define como de alto índice glucémico, bajo poder edulcorante y cariogénico. Los productos “deslactosados” pueden aumentar el sabor dulce por la predigestión del disacárido y el pardeamiento por reacciones de Maillard.
En el caso de la galactosa, se le atribuye contribuir con el neurodesarrollo temprano. La galactosa es la base para sintetizar gangliósidos, galactocerebrósidos y mucoproteínas.
Proteoma lácteo
La leche aporta aminoácidos esenciales, así como caseína, casiomorfinas y factores de crecimiento. Las caseínas son proteínas altamente inmunogénicas que pueden tener mimetismos con el gluten. La leche de especies actuales de vaca aporta β-caseínas A1. Diferente a la isoforma A2 que se encuentran en la leche humana, de cabra, oveja y búfala. Los estudios de los equipos de He y Jianqin contrastan que el uso de leche con β-caseínas A2 mejora o no empeora los síntomas en intolerantes a la lactosa. Ambos estudios constituyen una muestra de 645 individuos mayores de 20 años.
Por otro lado, las β-caseínas pueden ser transformadas en β-casiomorfinas (BCM). Esas BCM, en hígado, pueden afectar procesos de metilación. En el intestino, las BCM-7 pueden interactuar con receptores μ-opioideos, haciendo más lento el peristaltismo y aumentando la secreción mucosa.
Respecto a los factores de crecimiento, la Dra. Pocoví comenta que la leche puede aumentar el riesgo a padecer cáncer por la sobre activación de sensores nutricionales como el IGF-1. Sin embargo, en el artículo de Catanzaro y colaboradores, se defiende que la intolerancia a la lactosa parece aumentar el riesgo a patologías varias como el cáncer colorectal. Dicen que ese riesgo puede tener que ver con bajar la ingesta de lactosa, calcio, vitamina D, butirato, lactoferrina y ácido linolénico conjugado que contienen los lácteos. Algo similar al metanálisis de Szilagy y equipo. Ambos autores son conservadores y hablan de no crear alarmas con asociaciones que no deben confundirse con causas. Puede ser más interesante tratar la malnutrición y respetar los ciclos de ayuno e ingesta, como explica el Dr. Campillo en la clase gratuita sobre crononutrición.
Mecanismos evolutivos de la persistencia de la lactasa
Según predice la biología evolutiva, las mutaciones se seleccionan porque tienen un valor adaptativo para la supervivencia. Algunos polimorfismos genéticos permitieron digerir mejor la leche, lo cual a su vez supuso una mayor supervivencia, heredándose estas mutaciones. Parecería que la naturaleza se preguntó: ¿Qué mutaciones selecciono que optimicen la respuesta de este mamífero, quien ahora cría a otros mamíferos, ante un entorno de escasez de alimentos? La respuesta pareciera llegar en tres momentos de la historia humana. Con mutaciones aparecidas en tres zonas apartadas del planeta. Todas en regiones del cromosoma 2. Aquellos, con posibilidad de digerir lactosa de adultos, tenían una ventaja aumentada para transmitir sus genes o mayor fitness; de un 4-5% por generación. Aquello ocurrió por azar y la selección sigue teorías darwinistas. Este caso se sitúa entre las presiones selectivas más grandes conocidas dentro de la historia humana.
Se estima que las cunas de la persistencia a la lactasa fueron: el norte de Europa, oriente medio y en algunas regiones de África (ver la Tabla 1). Richard Evershed, pudo contrastar el empleo de lácteos en la alimentación humana, rastreando la presencia de estos genes mediante análisis bioquímicos de restos arqueológicos. Aproximadamente, datan de 9000 años atrás en Europa o medio oriente y de 7000 - 5000 en África. Además, coinciden con la aparición estimada de los genotipos de persistencia de la lactasa. Se considera un fascinante ejemplo de co-evolución genética y cultural.
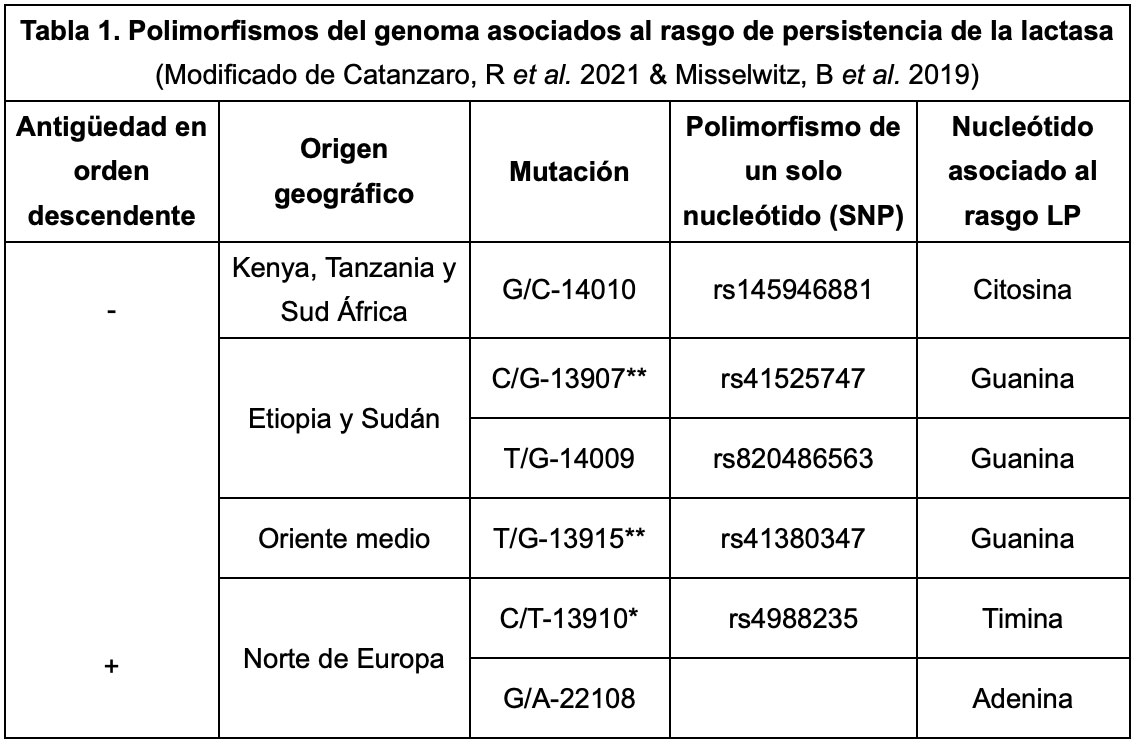
*Se considera el polimorfismo europeo con mayor peso en el rasgo LP, respecto al otro.
**Según la SNPedia, son polimorfismos africanos con menor peso en el rasgo LP.
Evolución clínica
Según la etiopatogenia, existen cuadros irreversibles como la alactasia congénita o la hipolactasia adulta. No se puede forzar mayor actividad o producción de LHP en estos individuos, pero se les pueden dar recursos para mejorar la digestión. Otros cuadros son reversibles como la intolerancia prematura en neonatos o la deficiencia secundaria de lactasa.
Conclusión
Tanto la persistencia de la lactasa como la no persistencia son variantes normales del metabolismo humano. No se debe considerar patológico una deficiencia de lactasa o la malabsorción de lactosa per se. Los lácteos son más que lactosa. Como matriz alimentaria presentan tanto ventajas como riesgos. El grado de presencia y activación de LHP, la integridad de la mucosa, el microbioma y la función colónica son factores que afectan a la absorción y digestión de lactosa.
Las pruebas diagnósticas más habituales son el test de aliento y la curva de glucemia. Podría no ser necesario llegar a dosis de 50 g de lactosa, ya que equivalen a beber de golpe 5 vasos de leche y no resulta una práctica de la vida cotidiana. En un análisis costes-beneficios, el test genético podría ser mejor usarlo solo en estudios epidemiológicos y contando varios polimorfismos. El test genético puede no ser el mejor patrón de contraste para valorar la sensibilidad y especificidad de una prueba.
La intolerancia a la lactosa puede derivar en síntomas digestivos y extra-digestivos que deberían ser tenidos en cuenta por los sanitarios. Algunas preparaciones culinarias y terapias pueden afectar el precio de la cesta de la compra, añadiendo a la adherencia al tratamiento más factores socioeconómicos.
"El estudio de los mecanismos de la digestión y la intolerancia a la lactosa ha aportado conocimientos no solamente sobre las causas dietéticas de los síntomas intestinales funcionales, sino también respecto a la evolución de la nutrición, cultura y estilo de vida humanos"
Misselwitz, B. et al. 2019
Definición de intolerancia a la lactosa
La lactosa es el azúcar principal de la leche humana; es un disacárido formado por glucosa y galactosa. La intolerancia a la lactosa es un defecto en la digestión y/o absorción de lactosa por ausencia y/o fallo funcional de LHP -deficiencia de LHP- sumado a sintomatología que comprometa el estado de bienestar, tras su ingesta.
Intolerancia a la lactosa = ingesta de lactosa + mala digestión y/o absorción + sintomatología problemática.
Causas de la intolerancia a la lactosa
La intolerancia a la lactosa puede ser congénita o adquirida. En la primera etapa de vida de los mamíferos, la leche constituye el alimento por excelencia y así de alta suele ser la actividad de la LHP. Algunos científicos defienden que la exposición a lactosa tiene un cierto grado de modulación en la expresión de una mala absorción y/o digestión, ya que existen procesos fisiológicos de “adaptación colónica” reversibles. Sin embargo, una mayor exposición no es garantía de mejor metabolismo. Se recomienda una exposición gradual. Generalmente, se habla de deficiencia de LHP cuando su actividad es menor al 50% o en ausencia de su expresión.
En el Homo sapiens sapiens, entre los 2 y los 10 años de edad, la LHP va dejando de ser tan activa. Sin embargo, varios factores genéticos, epigenéticos y ambientales han modulado nuestra respuesta digestiva a los lácteos. En algunos nativos finlandeses, se ha observado una reducción de actividad enzimática tardía: entre los 10 a los 20 años de vida. A esos individuos se les atribuye el rasgo de persistencia de la lactasa y su trasfondo genético fue confirmado por el equipo de Enattah en 2002. Las causas conocidas de intolerancia a la lactosa se clasifican en:
- Intolerancia prematura en neonatos: bebés con menos de 34 semanas de gestación pueden presentar inadecuada maduración digestiva y deficiencia transitoria de LHP.
- Deficiencia secundaria de lactasa: asociada a otros procesos patológicos como malnutrición o referentes al sistema inmunitario como alergia a proteína de leche de vaca o celiaquía o hipotiroidismo de Hashimoto o artritis reumatoide o síndrome de intestino irritable (SII) o sobrecrecimiento bacteriano (SIBO) o enfermedades inflamatorias intestinales (EII) tipo Crohn o colitis ulcerosa o infecciones como gastroenteritis por rotavirus o giardiasis o SIDA, y un largo etcétera.
- Deficiencia congénita de lactasa o alactasia: es un desorden genético de tipo recesivo que ocasiona nula o muy baja expresión de LHP. El artículo de Wanes y colaboradores detalla varias mutaciones asociadas a este cuadro clínico. Suele diagnosticarse al nacer y es poco frecuente.
- Deficiencia primaria de lactasa o hipolactasia adulta: el rasgo de no persistencia de lactasa se caracteriza por la pérdida progresiva de la proteína LHP y es más frecuente en el hombre. Por contra, el rasgo de persistencia de la lactasa solo está presente en un 35% de la población adulta.
Fisiología y fisiopatología
En el yeyuno medio suele expresarse más LHP, pero con una distribución heterogénea. La enzima LHP es capaz de separar la lactosa en sus monosacáridos y así facilita su absorción. Tras la digestión de lactosa, glucosa y galactosa pueden atravesar la membrana de los enterocitos mediante transportadores del tipo SGLUT, en compañía de sodio y agua. También pueden hacerlo por difusión facilitada mediante GLUTs y algún otro mecanismo. Posteriormente, llegan al hígado y siguen vías donde pueden ser usadas como fuente energética.
En el momento en que no es digerida por las células propias, la lactosa queda disponible para que las bacterias colónicas la transformen en ácidos grasos de cadena corta, CO2, H2 y otros metabolitos. Con bacterias del tipo Bifidobacterium y Lactobacillus no se producen los gases mencionados. De hecho, tener el SNP rs4988235 se ha asociado a poseer mayor cantidad de bifidobacterias. Además, durante la mala absorción/digestión se acumulan sustancias como acetaldehído, etanol, acetona y péptidos con toxicidad potencial. Cuando no se reabsorben estos desechos y se acumula la lactosa no hidrolizada, suele aumentar la osmolaridad y el peristaltismo. Es entonces cuando pueden aparecer síntomas y signos que ya describía Hipócrates hace unos 2400 años.
Clínica y síntomas
Para los síntomas y signos, se puede hablar de dos tiempos:
- A corto plazo: distensión abdominal, dolor, retortijones, náuseas, vómitos, gases, borborigmos y diarrea o estreñimiento en algunos casos.
- A largo plazo: disbiosis, inflamación, hiperpermeabilidad intestinal, afectaciones en la motilidad intestinal, en el ritmo cardiaco, ansiedad, fatiga, deterioro de la memoria, depresión, dolor de cabeza, músculo esquelético, dispareunia, úlceras en la mucosa oral, eccema, eritema anal, desarreglos en hormonas sexuales, mayor expresión de señales alérgicas (rinitis, asma o sinusitis) y déficit de nutrientes como el zinc, triptófano y la vitamina B9.
Se estima que los síntomas aparecen entre los 30 minutos y las 3 horas después de ingerir la lactosa; tener en cuenta que el vaciado gástrico en la mujer suele ser más lento que en el hombre. Además, la hipersensibilidad a la distensión y expectativas negativas ante los lácteos pueden tener efecto nocebo.
Para comunicación terapeuta-paciente puede ser práctico emplear escalas como la de Bristol, respecto a diferenciar diarrea de estreñimiento. Así como otras escalas con puntuaciones del 0 al 10, respecto al dolor y la distensión abdominal.
Diagnóstico
Parece más adecuado combinar tanto test de aliento como el de tolerancia a la lactosa, pero existen diversas pruebas asociadas a intolerancia a la lactosa.
- Test de aliento: las cantidades de gases (H2 y CH4) expirados son el parámetro de referencia tras la ingesta de 20 - 50 g de lactosa. Hay variantes de 3 - 6 h de prueba. Se da por positivo con incrementos de H2 mayores a 20 ppm y CH4 de mayores a 12 ppm. No suele emplearse en niños antes de los 6 años de edad.
- Test de tolerancia a la lactosa: la glucemia en sangre es el parámetro de referencia tras la ingesta de 50 g de lactosa. Se monitoriza este azúcar en sangre a los 0, 60 y 120 minutos. El diagnóstico es positivo si la glucemia aumenta menos de 20 mg/dl.
- Test de gaxilosa: se analiza la xilosa en orina. El lacTEST es un medicamento prescrito bajo receta. Para la prueba se sigue un protocolo que incluye la ingesta de 0,45 g de gaxilosa y tiene una duración de 5 horas. La prueba de LacTEST 0,45 g ≥ 19,18 se considera hipolactasia positiva con valores inferiores a 19,18 mg de xilosa. Se puede emplear a partir de los 12 años de edad.
- Test de pH en heces: sería positiva ante un pH ácido de las heces. Estaría indicada para cribado en lactantes, junto a otras pruebas complementarias como la biopsia.
- Biopsia intestinal: se evalúa la actividad de LHP. La prueba representa un examen histológico e incubación de muestras de intestino delgado. Requiere sedación, para practicar una esofagogastroduodenoscopia (EGD). Se considera positiva cuando la actividad de LHP es inferior a 10 U/g.
- Test genéticos: se analizan muestras de ADN -en sangre o saliva- en busca de genotipos asociados al rasgo LNP. Se reconocen varios polimorfismos. A nivel de población caucásica suele indicarse positivo si se posee la variante homozigota recesiva CC en la posición 13910 del gen MCM6. A la variante GG en la posición 22018 se le da menor peso para explicar el fenotipo. El gen MCM6 se encuentra a unas 1.4000 pares de bases del locus para proteína lactasa. Hay que tener en cuenta que los antepasados de oriente medio u áreas africanas pueden haber transmitido otras variantes a sus descendientes. Además de la información privada que representan estos test. Todo test genético es una prueba de paternidad.
La revisión de Misselwitz y colaboradores contiene un resumen de ventajas y desventajas de las pruebas diagnósticas más un diagrama de toma de decisiones. También, en la Asociación de intolerantes a la lactosa España (Adilac) se pueden consultar ejemplos de analíticas. Aunque aquellas herramientas no deberían sustituir al propio criterio del profesional sanitario.
Para un diagnóstico final es importante tanto la prueba positiva adecuada como la suma de síntomas clínicos de intolerancia a la lactosa. Dado que es frecuente los falsos positivos o negativos. Las pruebas actuales no cuentan con un 100% de especificidad y sensibilidad. Aunque circulan un estudio que valoró las pruebas usando el test genético para caucásicos como referencia. En ese estudio el test de gaxilosa obtuvo mejores puntuaciones: precisión de 0,93. Habría que contrastarlo.
Tratamiento
A continuación se habla de las estrategias y más adelante se hacen algunas descripciones nutricionales relevantes para el manejo de la intolerancia a la lactosa. El trabajo con adultos e infantes es distinto. En bebés, la lactancia materna se prioriza incluso ante diarrea aguda o prolongada, ya que la leche aporta mucho más que solo lactosa. Sin embargo, en algunos casos se prescribe el uso de leches de fórmula como en la alactasia congénita o en casos de malnutrición severa por problemas digestivos. En ambos grupos de edad pueden ser útiles los ensayos de tolerancia.
Los objetivos del tratamiento son:
- Reducir el riesgo de desnutrición o malnutrición del paciente.
- Detectar el rango de la ingesta de lactosa adecuada para el paciente.
Las estrategias se resumen en:
1) Uso de dietas reducidas o con exclusión de lácteos:
- Dieta antiinflamatoria: ricas en antioxidantes, libres de beta-caseína A1 y/o soja y/o gluten o símiles.
- Dieta baja en FODMAPs que, durante un tiempo prudencial, puede ser de ayuda en intolerancia secundaria, como la asociada a SII. Son herramientas dietéticas que se estudian en profundidad en el Máster en Nutrición Clínica y Patologías Digestivas del ICNS.
- Dietas adecuadas en calcio (moluscos y mariscos, pescado pequeños que se comen enteros, cantidades variables de crucíferas con cocciones adecuadas, legumbres, frutos secos y semillas) y coadyuvantes de su metabolismo.
2) Uso de suplementos:
- Enzima lactasa en comprimidos o gotas: se obtiene de hongos como el Aspergillus oryzae o levaduras como Kluyveronyces lactis. Su efecto en la disminución de los síntomas se estima modesto, de un 18%. Por ello, puede ser mejor combinarla con probióticos.
- Probióticos libres de proteínas lácteas y lactosa: el que parece tener más evidencia es el Bifidobacterium animalis. También se habla de Bifidobacterium longum, Lactobacillus bulgaricus, Lactobacillus acidophilus, Lactobacillus rhamnosus, Lactobacillus reuteri, Saccharomyces boulardii y Streptococcus thermophilus. Sus beneficios son tanto la digestión de lactosa como la producción de AGCC.
- Mezclas de prebióticos y probióticos: en bebés la propia leche humana aporta oligosacáridos presentes en leche humana (HMO) que nutren poblaciones de lactobacilos y bifidobacterias. Además de microbiota. En adultos, los lácteos fermentados, pueden cumplir ese papel doble. El kéfir aportaría levaduras como el Saccharomyces. Aunque este último también aporta un 1 a 2% de alcohol. Otros prebióticos, los galactooligosacáridos (GOS) además aumentan géneros como Roseburia spp y Faecalibacterium spp. Ensayos con GOS de cadena corta han mostrado mejorar síntomas de intolerancia a la lactosa.
- Postbióticos: en ocasiones se valora el uso de butirato, ya que alimenta al epitelio intestinal y ayuda con el sistema inmunitario.
- Grasas esenciales, vitaminas y minerales: valorar el uso de omega-3, vitamina D3, K, B6, magnesio, potasio y zinc para fortalecimiento del sistema inmunitario más facilitación de absorción de calcio.
3) Uso de sustitutivos gastronómicos:
Existen diferentes preparaciones culinarias que funcionan como alternativa gastronómica a la hora de sustituir lácteos. Con el asesorado hay que valorar el coste-beneficio de este cambio. Estos preparados pueden desplazar la ingesta de otros alimentos con mayor densidad nutricional. Sin embargo, los humanos somos seres con posibilidad de refuerzos a varios niveles. En la elección de alimentos influyen tanto determinantes biológicos como económicos, físicos o psicológicos que pueden usarse para favorecer la adherencia a una pauta de alimentación.

4) Atención a otros pilares de la salud:
Otros factores como el sueño, el ejercicio físico de fuerza o la salud mental son relevantes. Respecto a los síntomas extra-digestivos, puede ser interesante el trabajo interdisciplinar, que no multidisciplinar. Por ejemplo: un acompañamiento conjunto entre psicología y nutrición. Muchas personas llevan años lidiando con percepción de digestiones molestas y acaban imbuidas en un ciclo de interconsultas a sanitarios y/o autodiagnosticándose. Aquello empobrece la calidad de vida. La coexistencia de otras dificultades digestivas o de pérdida de peso debe evaluarse y diagnosticarse adecuadamente. La existencia de sintomatología restrictiva y psicológica debe hacernos sospechar sobre posibles trastornos alimentarios, bidireccionalmente relacionados con sintomatología digestiva, lo cual puede superar las competencias de un abordaje exclusivamente nutricional. Detalles como estos se abordan en el Curso de Especialización en Anorexia Nerviosa, Bulimia y Trastorno por Atracón de ICNS.
Alimentos con lactosa

Se debe saber que los lácteos son un alérgeno potencial. Por ello, el Reglamento (UE) Nº 1169/2011 recogen que deben aparecer resaltados en el listado de ingredientes. Se debe prestar atención a palabras como: lactosa, monohidrato de lactosa, suero o suero de leche o suero lácteo y sólidos lácteos. Es muy probable que no sepamos la cantidad de lactosa que aportan (ver Tabla 3). Para una orientación, se debe contrastar ingredientes con cantidades de hidratos de carbono de la tabla de composición o directamente consultar al fabricante. Las alegaciones como “sin lactosa”, “libre de lactosa” o “deslactosado” pueden resultar confusas y no tienen una normativa estandarizada, excepto en fórmulas infantiles: su contenido en lactosa debe ser de hasta 10 mg de lactosa por cada 100 kcal. En España los productos con 0% de lactosa pueden contener <0.01% de la misma.

*La abreviatura c/s hace referencia a cucharada sopera. Según el Codex Alimentarius, las leches de fórmula pueden contener hasta un 30% de los azúcares en forma de maltodextrinas, con lo que se resta lactosa.
¿Qué cantidad de lactosa es adecuada?
No hay una sola respuesta. Una revisión habla de tolerancias de 5 g por toma. Se supone que, por ello, clasifican a los alimentos con estrategias de simplificación como un semáforo. Un ejemplo está en la Tabla 4. Por otro lado, un metanálisis concluye que los adultos intolerantes a la lactosa suelen aceptar dosis de 12 g de lactosa en una toma y hasta 25 g al día.

¿Cómo implementar un ensayo de tolerancia?
Se suele empezar por dietas libres de lactosa. A largo plazo, se adapta al rango de tolerancia. Se puede pactar con el paciente el llevar un registro incluyendo: fecha, producto ingerido, cantidad, síntomas, tiempo tras la ingesta y conclusiones. Es interesante fraccionar la ingesta de lactosa y acompañarla de otros alimentos con presencia nula de la misma. Aunque debemos valorar la posibilidad de contaminación cruzada en intolerantes extremos. De cada producto puede modificar las raciones en ¼, ½ o 1 dentro de escala baja del semáforo e ir ascendiendo. Es un trabajo de prueba y error. Puede hablarse de un entrenamiento digestivo. Los quesos curados y los yogures enteros naturales suelen tener buena tolerancia.
Por si hay interacciones, se puede tener en cuenta que otros monosacáridos como la fructosa usan vías de entrada al enterocito compartidas. Aunque, la fructosa además cuente con su vía exclusiva de transporte: los GLUT5. También que la lactosa puede estar presente en fármacos, como excipiente.
Calidad de los lácteos
Los lácteos son una fuente de energía, ácidos grasos, proteínas de alto valor biológico, calcio, fósforo, vitamina D, B12 y otros. A nivel de impacto metabólico, es preferible seleccionar lácteos en sus versiones más naturales, enteros y valorar su digestibilidad: queso curado, yogur natural, kéfir, leche entera materna, de cabra y oveja. Los productos enteros aumentan el efecto saciante gracias a las grasas.
Por estudios pre-clínicos, se considera que el efecto acidificante de la lactosa en el intestino mejoran la absorción de otros minerales como magnesio y zinc, pero faltaría confirmarlo en humanos. A la lactosa también se le define como de alto índice glucémico, bajo poder edulcorante y cariogénico. Los productos “deslactosados” pueden aumentar el sabor dulce por la predigestión del disacárido y el pardeamiento por reacciones de Maillard.
En el caso de la galactosa, se le atribuye contribuir con el neurodesarrollo temprano. La galactosa es la base para sintetizar gangliósidos, galactocerebrósidos y mucoproteínas.
Proteoma lácteo
La leche aporta aminoácidos esenciales, así como caseína, casiomorfinas y factores de crecimiento. Las caseínas son proteínas altamente inmunogénicas que pueden tener mimetismos con el gluten. La leche de especies actuales de vaca aporta β-caseínas A1. Diferente a la isoforma A2 que se encuentran en la leche humana, de cabra, oveja y búfala. Los estudios de los equipos de He y Jianqin contrastan que el uso de leche con β-caseínas A2 mejora o no empeora los síntomas en intolerantes a la lactosa. Ambos estudios constituyen una muestra de 645 individuos mayores de 20 años.
Por otro lado, las β-caseínas pueden ser transformadas en β-casiomorfinas (BCM). Esas BCM, en hígado, pueden afectar procesos de metilación. En el intestino, las BCM-7 pueden interactuar con receptores μ-opioideos, haciendo más lento el peristaltismo y aumentando la secreción mucosa.
Respecto a los factores de crecimiento, la Dra. Pocoví comenta que la leche puede aumentar el riesgo a padecer cáncer por la sobre activación de sensores nutricionales como el IGF-1. Sin embargo, en el artículo de Catanzaro y colaboradores, se defiende que la intolerancia a la lactosa parece aumentar el riesgo a patologías varias como el cáncer colorectal. Dicen que ese riesgo puede tener que ver con bajar la ingesta de lactosa, calcio, vitamina D, butirato, lactoferrina y ácido linolénico conjugado que contienen los lácteos. Algo similar al metanálisis de Szilagy y equipo. Ambos autores son conservadores y hablan de no crear alarmas con asociaciones que no deben confundirse con causas. Puede ser más interesante tratar la malnutrición y respetar los ciclos de ayuno e ingesta, como explica el Dr. Campillo en la clase gratuita sobre crononutrición.
Mecanismos evolutivos de la persistencia de la lactasa
Según predice la biología evolutiva, las mutaciones se seleccionan porque tienen un valor adaptativo para la supervivencia. Algunos polimorfismos genéticos permitieron digerir mejor la leche, lo cual a su vez supuso una mayor supervivencia, heredándose estas mutaciones. Parecería que la naturaleza se preguntó: ¿Qué mutaciones selecciono que optimicen la respuesta de este mamífero, quien ahora cría a otros mamíferos, ante un entorno de escasez de alimentos? La respuesta pareciera llegar en tres momentos de la historia humana. Con mutaciones aparecidas en tres zonas apartadas del planeta. Todas en regiones del cromosoma 2. Aquellos, con posibilidad de digerir lactosa de adultos, tenían una ventaja aumentada para transmitir sus genes o mayor fitness; de un 4-5% por generación. Aquello ocurrió por azar y la selección sigue teorías darwinistas. Este caso se sitúa entre las presiones selectivas más grandes conocidas dentro de la historia humana.
Se estima que las cunas de la persistencia a la lactasa fueron: el norte de Europa, oriente medio y en algunas regiones de África (ver la Tabla 1). Richard Evershed, pudo contrastar el empleo de lácteos en la alimentación humana, rastreando la presencia de estos genes mediante análisis bioquímicos de restos arqueológicos. Aproximadamente, datan de 9000 años atrás en Europa o medio oriente y de 7000 - 5000 en África. Además, coinciden con la aparición estimada de los genotipos de persistencia de la lactasa. Se considera un fascinante ejemplo de co-evolución genética y cultural.

*Se considera el polimorfismo europeo con mayor peso en el rasgo LP, respecto al otro.
**Según la SNPedia, son polimorfismos africanos con menor peso en el rasgo LP.
Evolución clínica
Según la etiopatogenia, existen cuadros irreversibles como la alactasia congénita o la hipolactasia adulta. No se puede forzar mayor actividad o producción de LHP en estos individuos, pero se les pueden dar recursos para mejorar la digestión. Otros cuadros son reversibles como la intolerancia prematura en neonatos o la deficiencia secundaria de lactasa.
Conclusión
Tanto la persistencia de la lactasa como la no persistencia son variantes normales del metabolismo humano. No se debe considerar patológico una deficiencia de lactasa o la malabsorción de lactosa per se. Los lácteos son más que lactosa. Como matriz alimentaria presentan tanto ventajas como riesgos. El grado de presencia y activación de LHP, la integridad de la mucosa, el microbioma y la función colónica son factores que afectan a la absorción y digestión de lactosa.
Las pruebas diagnósticas más habituales son el test de aliento y la curva de glucemia. Podría no ser necesario llegar a dosis de 50 g de lactosa, ya que equivalen a beber de golpe 5 vasos de leche y no resulta una práctica de la vida cotidiana. En un análisis costes-beneficios, el test genético podría ser mejor usarlo solo en estudios epidemiológicos y contando varios polimorfismos. El test genético puede no ser el mejor patrón de contraste para valorar la sensibilidad y especificidad de una prueba.
La intolerancia a la lactosa puede derivar en síntomas digestivos y extra-digestivos que deberían ser tenidos en cuenta por los sanitarios. Algunas preparaciones culinarias y terapias pueden afectar el precio de la cesta de la compra, añadiendo a la adherencia al tratamiento más factores socioeconómicos.
"El estudio de los mecanismos de la digestión y la intolerancia a la lactosa ha aportado conocimientos no solamente sobre las causas dietéticas de los síntomas intestinales funcionales, sino también respecto a la evolución de la nutrición, cultura y estilo de vida humanos"
Misselwitz, B. et al. 2019
Catanzaro, R., Sciuto, M., & Marotta, F. (2021). Lactose intolerance: An update on its pathogenesis, diagnosis, and treatment. Nutrition research (New York, N.Y.), 89, 23–34. https://doi.org/10.1016/j.nutres.2021.02.003
CESNID (2009). Libro: Tabla de composición de alimentos por medidas caseras de consumo habituales en España. Editorial McGraw-Hill. ISBN: 978-84-481-6090-6
Corneal, M., Scher, J., Ritie-Pertusa, L., Le, D. T. L., Petit, J., Nikolova, Y., Banon, S., & Gaiani, C. (2017). Recent advances on lactose intolerance: Tolerance thresholds and currently available answers. Critical reviews in food science and nutrition, 57(15), 3344–3356. https://doi.org/10.1080/10408398.2015.1123671
Curry A. (2013). Archaeology: The milk revolution. Nature, 500(7460), 20–22. https://doi.org/10.1038/500020a
de Lorenzo, D., Portero-Otín, M., Pamplona, R. (2011). Libro: Nutrigenómica y nutrigenética. Hacia la nutrición personalizada. Editorial Librooks Barcelona, S.L.L. ISBN: 978-84-938910-1-5.
de Lorenzo, D. Tema 4 del curso nutrigenómica para profesionales de la nutrición. Instituto nutrigenómica..
Enattah, N. S., Sahi, T., Savilahti, E., Terwilliger, J. D., Peltonen, L., & Järvelä, I. (2002). Identification of a variant associated with adult-type hypolactasia. Nature genetics, 30(2), 233–237. https://doi.org/10.1038/ng826
Facioni, M. S., Raspini, B., Pivari, F., Dogliotti, E., & Cena, H. (2020). Nutritional management of lactose intolerance: the importance of diet and food labelling. Journal of translational medicine, 18(1), 260. https://doi.org/10.1186/s12967-020-02429-2
García Luna, P. P., & López Gallardo, G. (2007). Evaluación de la absorción y metabolismo intestinal [Study on intestinal absorption, metabolism, and adaptation]. Nutricion hospitalaria, 22 Suppl 2, 5–13.
Heyman, M. B., & Committee on Nutrition (2006). Lactose intolerance in infants, children, and adolescents. Pediatrics, 118(3), 1279–1286. https://doi.org/10.1542/peds.2006-1721
Infante D. (2008). Intolerancia a la lactosa: en quién y por qué [Lactose intolerance]. Anales de pediatria (Barcelona, Spain : 2003), 69(2), 103–105. https://doi.org/10.1157/13124885
Kuokkanen, M., Enattah, N. S., Oksanen, A., Savilahti, E., Orpana, A., & Järvelä, I. (2003). Transcriptional regulation of the lactase-phlorizin hydrolase gene by polymorphisms associated with adult-type hypolactasia. Gut, 52(5), 647–652. https://doi.org/10.1136/gut.52.5.647
Lomer, M. C., Parkes, G. C., & Sanderson, J. D. (2008). Review article: lactose intolerance in clinical practice--myths and realities. Alimentary pharmacology & therapeutics, 27(2), 93–103. https://doi.org/10.1111/j.1365-2036.2007.03557.x
Misselwitz, B., Butter, M., Verbeke, K., & Fox, M. R. (2019). Update on lactose malabsorption and intolerance: pathogenesis, diagnosis and clinical management. Gut, 68(11), 2080–2091. https://doi.org/10.1136/gutjnl-2019-318404
Pocovi, G. (2023). Libro: Atención con la inflamación. Guía para combatir la inflamación crónica y mejorar tu sistema inmune. 3ª ed. Editorial Planeta, S.A. ISBN: 978-84-08-26579-5
Robette, N., Génin, E., & Clerget-Darpoux, F. (2022). Heritability: What's the point? What is it not for? A human genetics perspective. Genetica, 150(3-4), 199–208. https://doi.org/10.1007/s10709-022-00149-7
Savaiano, D. A., Boushey, C. J., & McCabe, G. P. (2006). Lactose intolerance symptoms assessed by meta-analysis: a grain of truth that leads to exaggeration. The Journal of nutrition, 136(4), 1107–1113. https://doi.org/10.1093/jn/136.4.1107
Succoio, M., Sacchettini, R., Rossi, A., Parenti, G., & Ruoppolo, M. (2022). Galactosemia: Biochemistry, Molecular Genetics, Newborn Screening, and Treatment. Biomolecules, 12(7), 968. https://doi.org/10.3390/biom12070968
Swallow D. M. (2003). Genetics of lactase persistence and lactose intolerance. Annual review of genetics, 37, 197–219. https://doi.org/10.1146/annurev.genet.37.110801.143820
Szilagyi, A., Nathwani, U., Vinokuroff, C., Correa, J. A., & Shrier, I. (2006). Evaluation of relationships among national colorectal cancer mortality rates, genetic lactase non-persistence status, and per capita yearly milk and milk product consumption. Nutrition and cancer, 55(2), 151–156. https://doi.org/10.1207/s15327914nc5502_5
Pérez, I y Caballero, B. Herramienta Intolerancia a la lactosa. Experty® App
Toca, M. D. C., Fernández, A., Orsi, M., Tabacco, O., & Vinderola, G. (2022). Lactose intolerance: myths and facts. An update. Intolerancia a la lactosa: mitos y verdades. Actualización. Archivos argentinos de pediatria, 120(1), 59–66. https://doi.org/10.5546/aap.2022.eng.59
Vicente, M., Priehodová, E., Diallo, I., Podgorná, E., Poloni, E. S., Černý, V., & Schlebusch, C. M. (2019). Population history and genetic adaptation of the Fulani nomads: inferences from genome-wide data and the lactase persistence trait. BMC genomics, 20(1), 915. https://doi.org/10.1186/s12864-019-6296-7
Wanes, D., Husein, D. M., & Naim, H. Y. (2019). Congenital Lactase Deficiency: Mutations, Functional and Biochemical Implications, and Future Perspectives. Nutrients, 11(2), 461. https://doi.org/10.3390/nu11020461



















